뉴스
CDER, 대대적 조직 개편 진행…어떤 부분 바뀌나
질환 분야별 개편 및 새 부서 신설…전문성 및 효율성 강화
전세미 기자 │ jeonsm@yakup.com


입력 2019-11-18 12:31 수정 2019.11.18 14:10
미국 FDA 내 약물 평가 연구 센터(Center for Drug Evaluation Research, CDER)가 14년 만에 대대적인 조직 개편을 진행할 것으로 보여 주목된다.
CDER의 이번 조직 개편은 조직 차원에서 더 나은 ‘효율성’을 만들어나가야 한다는 지침에 따른 것이다. 글로벌 약물 규제의 표준으로 자리한 CDER지만, 진화하는 기술과 최신 과학, 의료 및 규제 발전의 변화 등이 이번 조직 개편의 배경이 된 것으로 보인다.
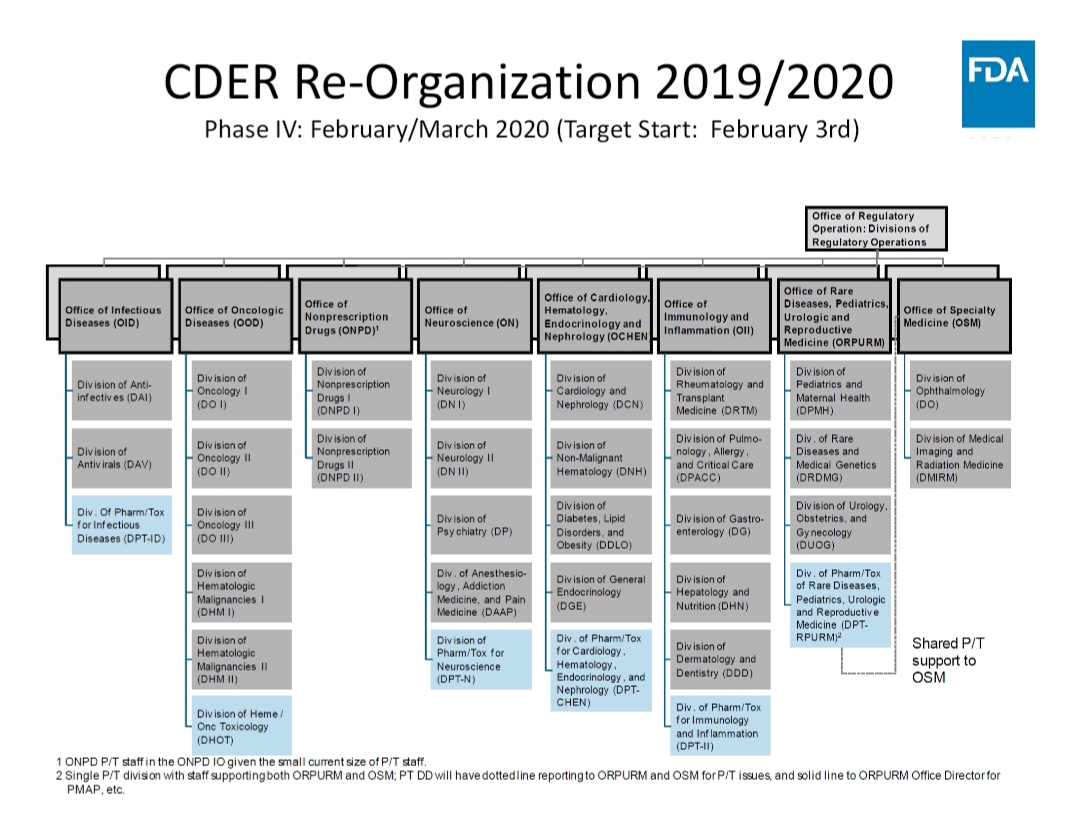
관련 업계에 따르면, 조직 개편의 가장 큰 차이점은 약물 승인을 감독하는 큰 틀에서의 운영진 배치, 분야별 전문성을 띈 새로운 부서 신설이다.
큰 틀을 보면, 기존 CDER의 조직도는 신약 업무국(Office of New Drugs, OND) 아래 6개 부서가 존재하며, 각 부서마다 3~4개의 세부 업무팀을 두고 있다.
그러나 오는 2020년에는 신약 업무국 총괄 아래 임상과 운영 부문의 부국장 지위가 각각 추가로 신설될 예정이다. 또 약리학/독성학(pharm/tox) 전문가, 스페셜 프로그램 스태프(special programs staff) 등이 배치된다.
약물 승인 감독 관련 부서는 대대적인 변화가 예고됐다. 부서들은업무 중심이었던 이전과 달리 질환 분야별로 개편되며, 기존 6개였던 중간 부서는 8개로 늘어난다.
CDER의 이번 조직 개편은 조직 차원에서 더 나은 ‘효율성’을 만들어나가야 한다는 지침에 따른 것이다. 글로벌 약물 규제의 표준으로 자리한 CDER지만, 진화하는 기술과 최신 과학, 의료 및 규제 발전의 변화 등이 이번 조직 개편의 배경이 된 것으로 보인다.
|
관련 업계에 따르면, 조직 개편의 가장 큰 차이점은 약물 승인을 감독하는 큰 틀에서의 운영진 배치, 분야별 전문성을 띈 새로운 부서 신설이다.
큰 틀을 보면, 기존 CDER의 조직도는 신약 업무국(Office of New Drugs, OND) 아래 6개 부서가 존재하며, 각 부서마다 3~4개의 세부 업무팀을 두고 있다.
그러나 오는 2020년에는 신약 업무국 총괄 아래 임상과 운영 부문의 부국장 지위가 각각 추가로 신설될 예정이다. 또 약리학/독성학(pharm/tox) 전문가, 스페셜 프로그램 스태프(special programs staff) 등이 배치된다.
약물 승인 감독 관련 부서는 대대적인 변화가 예고됐다. 부서들은업무 중심이었던 이전과 달리 질환 분야별로 개편되며, 기존 6개였던 중간 부서는 8개로 늘어난다.
중간 부서 중 6곳은 약리학/독성학을 담당하는 하위 부서가 증설됐다. 이는 최근 약물 기전 및 독성 파악이 중요해짐에 따라 조직 내 전문성과 객관성을 강화하기 위한 것으로 보인다.
이 외에도 새로운 약물평가부(Office of Drug Evaluation Sciences)와 신약정책부(Office of New Drug Policy), 생물의약품 및 바이오시밀러부(Office of Therapeutic Biologics and Biosimilars) 등의 부서가 신설될 전망이다.
CDER의 E. 데니스 바쇼(E. Dennis Bashaw) 박사는 “약물 평가 및 연구 센터의 재구성은 응용 프로그램의 검토 평가에서 주요 패러다임 전환을 나타낸다. 의료 분야의 역사적 하위 부문이 아닌 근본적인 행동 메커니즘에 중점을 두기 때문이다”고 말했다.
이어 “FDA는 앞으로 ‘심사(review)’라는 표현을 더 이상 쓰지 않고 ‘평가(assessment)’라는 표현을 사용할 것이다. 그만큼 신약 개발사와 더 유기적이고 협조적인 관계를 형성하겠다는 의미”라고 전했다.
CDER의 E. 데니스 바쇼(E. Dennis Bashaw) 박사는 “약물 평가 및 연구 센터의 재구성은 응용 프로그램의 검토 평가에서 주요 패러다임 전환을 나타낸다. 의료 분야의 역사적 하위 부문이 아닌 근본적인 행동 메커니즘에 중점을 두기 때문이다”고 말했다.
이어 “FDA는 앞으로 ‘심사(review)’라는 표현을 더 이상 쓰지 않고 ‘평가(assessment)’라는 표현을 사용할 것이다. 그만큼 신약 개발사와 더 유기적이고 협조적인 관계를 형성하겠다는 의미”라고 전했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 메쥬, 코스닥 기술특례상장 기술성평가 통과 -
02 뉴로핏, 청약경쟁률 1922.75대 1-증거금 6.7... -
03 젠바디, 호흡기 감염병 ‘hMPV 신속진단제품... -
04 코아스템켐온 "오가노이드 구축한다…에이티... -
05 파로스아이바이오 윤정혁 대표, 자사주 매입... -
06 로킷헬스케어, 글로벌 투자자로 300억원 전... -
07 프로티나, 공모가 1만4000원…수요예측 경쟁... -
08 K-뷰티 북미 공략 본격화… 'CPNA 2025' 한국... -
09 "VC·AC 주목해주세요" 유망 스타트업 투자유... -
10 차바이오텍,CAR-NK·TIL 세포치료제 개발 속...











