뉴스
"'디지털 약' 미충족 니즈 제약시장 '판' 바꾼다"
미국 시장 2023년 44억까지 성장…새로운 정의·원칙 준수 필요
이승덕 기자 │ duck4775@yakup.com


입력 2019-11-05 06:01 수정 2019.11.05 09:07
알약이나 주사제가 아닌 디지털 기술을 활용해 질병을 치료하는 '디지털 치료제'가 향후 시장 전체의 판을 확대·변화할 것으로 예상되는 가운데, 새롭게 수립된 원칙과 정의를 준수할 필요성이 제기됐다.

|
기존의 먹는 알약이나 주사제가 아닌 디지털 기술(소프트웨어)로 환자를 치료하는 새로운 개념의 디지털 치료제(Digital Therapeutics, DTx) 등장했다.
'디지털 치료제(이하 디지털 약)'는 질병 및 장애을 예방, 관리 및 치료하기 위한 고품질 소프트웨어 프로그램을 기반으로, 환자에게 근거 중심 치료(evidence-based therapeutic)를 제공하는 것으로 정의됐다.
디지털 약은 환자의 치료 및 건강결과를 최적화하기 위해 독립적으로 사용되거나 의약품, 의료기기 및 기타 치료법들과 병행해 사용할 수 있고, 임상시험으로 치료 효과를 검증받고 규제기관의 인허가를 거쳐 의사 처방으로 환자에게 제공돼 보험 적용도 가능하다는 점에서 일반 약과 동일한 특성을 띄고 있다.
디지털 약이 헬스케어 생태계 전반에 걸쳐 지속적으로 통합되면 전 세계적으로 헬스케어의 전달방식에 더 많은 영향을 미칠 것으로 예상되고 있다.
특히 디지털 약이 추가 기능을 통합할 수 있는 고유한 능력을 보유하고 있어 모바일 건강관리 플랫폼과의 통합이 기대되고 있다. 일례로, 진단장치·센서 및 웨어러블과 연결하는 기능, 원격 치료, 전자 처방 투여 및 의료기록 플랫폼과 통합이 가능한 식이다.
디지털 약은 2017년 9월 중독 치료 어플리케이션 '리셋(reSET)'이 최초로 미국 FDA의 허가를 받으면서 관련 산업에 대한 관심이 집중됐다.

|
스마트폰 및 컴퓨터 사용에 익숙한 인구 성장과 5G 초고속 인터넷 발달로 디지털 치료제가 보급화 될 수 있는 기반이 마련된 상황에서 효과적이고 효율적인 디지털 치료제에 대한 수요가 급격히 증가할 수 있다는 것.
산업 전반에 걸쳐 디지털 치료제 제품으로 전달되고 있는 치료제 유형은 질병 상태만큼이나 다양하고, 디지털 약 분야가 성장함에 따라 환자, 의료제공자 및 정부와 민간 보험사를 포함한 지불자는 신체적, 정신적, 행동적 질병상태에 대한 보다 포괄적인 치료 옵션을 기대할 수 있다는 설명이다.
디지털 치료제는 미국을 중심으로 새롭게 산업군이 형성되고 있다.
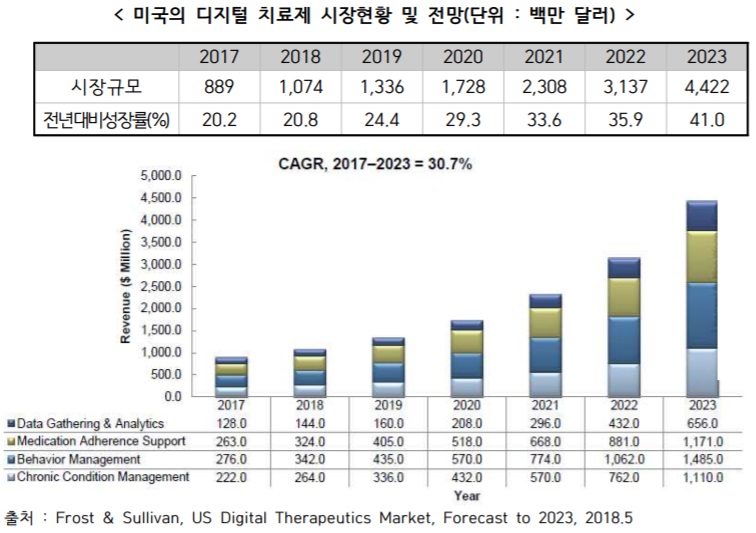
미국 내 시장규모는 2017년 8.9억 달러에서 연평균 30.7%의 높은 성장률로 성장해 2023년에는 44.2억 달러를 형성할 전망이다.
Frost & Sullivan의 최근 자료에 따르면, 디지털 약 산업은 매우 초기 단계에 있으나, 성장이 매우 높은 산업으로 평가받고 있다. 세부적으로는 크게 4개 분야로 구분되는데, 행동 관리(behavior management)가 31%, 처방 준수 지원(Medication Adherence Support) 29.6%, 만성질환 관리(chronic condition management) 25%, 데이터 수집 및 분석(Data Gathering & Analytics)이 14.4%를 점유하고 있다.
|
이 같은 디지털 약이 기존 의약품을 보조하거나 대체할 수 있는 치료법으로 제공되기 위해서는 미국 FDA 승인이 필수적이다.
리셋은 미 FDA 승인(2017.9)을 통해 마약(오피오이드)를 제외한 알콜, 코카인, 마리화나 중독의 치료 효과를 확인했다.
2018년 12월에는 Pear Therapeutics와 산도스(Sandoz) 공동으로 개발한 마약(오피오이드) 의존 장애 환자 치료를 위한 모바일 어플리케이션 'reSET-O'가 두 번째 디지털 약으로 FDA 승인을 획득했다. 이와 관련 Pear Therapeutics는 올해 7월 만성 불면증 및 우울증 치료제 Somryst의 판매 승인을 FDA에 신청했다.
Akili Interactive Labs는 주의력결핍과잉행동장애(ADHD) 치료용 비디오 게임, 모바일 앱을 개발해 임상시험 진행 중이며, Click Therapeutics, MySugar(Roche Diabetes Care), WellDoc, Proteus Digital Health, Omada Health, Chrono Therapeutics 등도 디지털 치료제 약을 주력으로 추진 중이다.
2017년에는 미국을 중심으로 한 9개국에서 디지털 약을 개발하는 산업계의 비영리 협회 '디지털 치료제 얼라이언스(Digital Therapeutics Alliance, DTA)'가 설립됐다.
DTA는 현재 총 28개 업체가 회원사로 있는데, 노바티스, 머크, 사노피, 오츠카 등 글로벌 제약사와 Akili, Pear therapeutics, Big Health, Propeller, Omada 등 신생업체가 골고루 분포돼 있다.
DTA는 2018년 10월 새로운 산업 영역인 디지털 치료제 산업에 대한 정의를 확립하고, 제품설계, 제조, 임상평가 및 규제감독에 관한 핵심원칙·모범사례를 담은 종합적 산업 보고서(Digital Therapeutics : Combining Technology and Evidence-based Medicine to Transform Personalized Patient Care)를 발간했다.
보고서에 따르면, '디지털 치료제'는 의학적 장애 또는 질병을 예방, 관리 및 치료하기 위해 고품질 소프트웨어 프로그램으로 구동되는 근거 중심 치료를 환자에게 제공하는 물질이다.
DTA는 "디지털 치료제가 제공하는 다양한 중재 및 질병 유형을 고려할 때, 모든 디지털 치료 제품은 업계에서 채택한 10가지 핵심 원칙(Core Principles)을 준수하는 것이 중요하다"고 밝혔다.
10가지 핵심원칙은 △의학적 장애 또는 질병을 예방·관리 및 치료 △소프트웨어에 의해 주도되고, 소프트웨어 또는 보완 하드웨어, 의료기기, 서비스 또는 의약품으로 제공되는 의료 개입 생성 △디자인, 제조 및 품질 모범 사례 통합 △제품 개발 및 사용성 프로세스에서 최종 사용자(end users) 참여 △환자 개인정보 보호 및 보완 보호(security protections) 기능 통합 등이 이에 해당된다.
또한 △제품 배포, 관리 및 유지 관리 모범 사례 적용 △동료 심사 저널에서 임상적으로 의미 있는 결과를 포함한 임상시험 결과 공개 △위험, 유효성 및 의도된 사용에 대한 규제기관의 검토 및 승인 필요 △임상 검증 및 규제 상태에 대한 적합한 클레임 제시 △실제 증거(real world evidence) 및 제품 성능 데이터 수집, 분석 및 적용 등도 이에 포함된다.
DTA는 또한 "모든 디지털 치료 제품이 충족해야 할 핵심원칙을 바탕으로 디자인·개발·제조, 임상검증 및 규제와 관련된 모범사례 확립을 위해 노력해야 한다"고 제언했다.
[관련기사]
'새 술은 새 부대에'…디지털약, 정부·제약 변화 필요
2019-01-29 12:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 제니텍 홍성창 회장,'2026년 한국을 이끌 혁... -
02 "제약바이오산업과, 현장 목소리 신속하고 ... -
03 [신년사] 제약바이오헬스산업 경쟁력 강화 ... -
04 [신년사]"약가 개편 등 위기… 290개 회원사 ... -
05 [신년사] "K-바이오, 추격자 넘어 혁신 주체... -
06 [신년사]革故鼎新(혁고정신), 2026년 제약 ... -
07 ★대상 부산오거리약국 황은경약사 -
08 [신년사] "유통의 가치가 재조명되는 전환의... -
09 [신년사] "행동·실천으로 회원과 함께 여는 ... -
10 [신년사] "환자중심 전문약료로 신뢰받는 병...











