
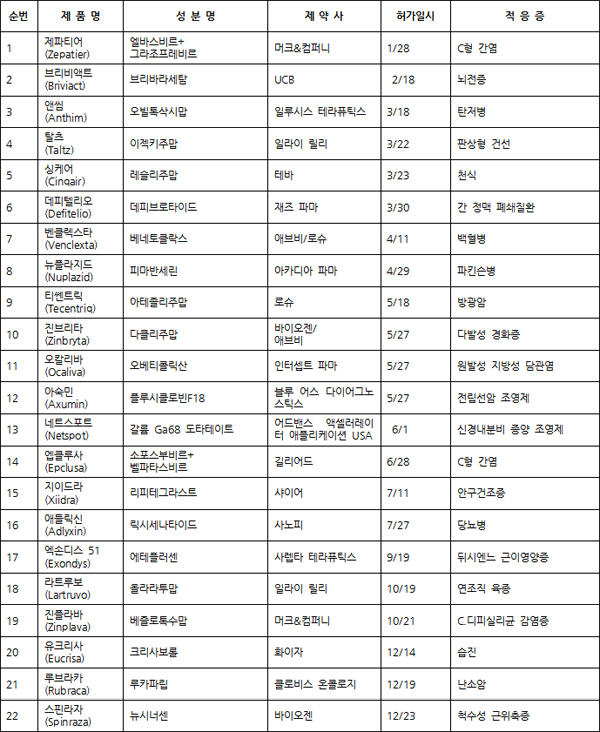
신규조성물(NMEs) 신약 및 신규 생물의약품을 포함해 총 22개(12월 28일 현재 기준)의 신약들이 2016년 한해 동안 FDA의 허가관문을 통과한 것으로 나타났다.
FDA 약물평가연구센터(CDER)의 신규조성물 신약 및 신규 생물의약품 허가현황 자료에 따르면 지난 23일 최초의 척수성 근위축증 치료제로 허가를 취득한 바이오젠社의 ‘스핀라자’(Spinraza: 뉴시너센)까지 포함하더라도 전체 승인건수가 지난해의 45개에 미치지 못한 것으로 분석됐다.
참고로 지난해에는 희귀질환 치료제만도 전체 허가취득 신약의 절반에 육박하는 21개에 달하면서 47%를 점유한 것으로 집계됐었다. 그렇다면 전체 신약 허가건수가 지금까지 가장 많은 수의 새로운 희귀질환 치료제들이 FDA로부터 승인받은 해로 기록된 2015년의 21개와 앞‧뒷집 차이를 내보이는 데 그친 셈이다.
당초 애널리스트들은 올해 총 25개의 신규조성물 신약 및 생물의약품 신약들이 FDA의 허가를 취득할 수 있을 것으로 예상해 왔다.
하지만 이 수치는 12월 중으로 허가취득이 기대되었던 로슈社의 다발성 경화증 치료제 ‘오크레버스’(Ocrevus: 오크렐리주맙)과 셈프라社(Cempra)의 마크로라이드 계열 항균제 ‘솔리테라’(Solithera: 솔리스로마이신)까지 포함한 것이다.
‘오크레버스’는 지난 20일 FDA가 검토기간을 3개월 연장키로 했으며, ‘솔리테라’는 29일 FDA로부터 “불허한다”를 통보받았다.
이 중 ‘오크레버스’는 2016년 최대의 허가취득 사례가 될 수 있을 것이라는 전망까지 제기되면서 또 하나의 블록버스터 드럭 출현을 고대하케 했던 기대주이다.
또 다른 기대주였던 일라이 릴리社의 알쯔하이머 치료제 솔라네주맙(solanezumab)의 경우 지난달 개발이 실패로 귀결되면서 새삼 신약개발에 내재된 위험성을 환기시킨 바 있다.
이에 따라 설령 ‘오크레버스’와 ‘솔리테라’가 허가관문을 넘어섰더라도 2016년은 FDA의 허가를 취득한 신약들의 숫자가 크게 감소한 해로 기록되면서 최근 2년 동안 눈에 띄었던 연구‧개발 생산성 향상이 단지 일시적인 상황변화에 불과한 것이었을 수 있다는 관측에 무게가 실리게 할 것으로 보인다.
지난해의 경우 11월 말까지만 하더라도 총 40개의 신규조성물 신약들이 FDA로부터 발매를 승인받아 2014년 및 2013년의 기록을 조기에 훌쩍 뛰어넘은 바 있기 때문이다.
▉ 2016년 FDA 신약 허가현황
|
-
01 한국콜마, 세계적 화학기업 '바스프' 손잡... -
02 '2000억원' 규모 26년 국가신약개발사업 스... -
03 대한약사회, 건보공단 특사경 도입 '찬성'…... -
04 대한약사회, 대웅제약에 '블록형 거점도매 ... -
05 한올바이오, 오송 특화공장 신축 투자 중단 -
06 한국유니온제약,M&A 공고...'스토킹호스' 방... -
07 IVI-질병관리청, 팬데믹 대응 임상시험검체... -
08 GC녹십자, 코로나19 mRNA 백신 국내 임상 1... -
09 마이크로디지탈, 셀트리온 생산공정에 ‘더... -
10 디앤디파마텍, “FDA의 AI 기반 MASH 조직 분...











