
|
케어젠(대표 정용지)은 3일 오전 한국거래소 컨퍼런스 홀에서 열린 기업설명회(IR)에서 신약 CG-P5 점안액 미국 임상 1상 중간 결과를 발표했다. 이번 임상은 노인성 습성 황반변성(AMD) 환자를 대상으로 안전성과 유효성을 평가하기 위해 설계됐으며, 미국 내 6개 병원에서 진행 중이다
임상은 ▲ CG-P5 점안액 투여군 ▲ 위약(플라시보) 투여군 ▲ 양성대조군(아일리아 치료군) 으로 나누어 진행됐다. CG-P5 점안액 투여군과 위약 투여군은 이중맹검(double-blind) 방식으로 매일 1회, 3개월 동안 투약 받았고, 양성대조군은 한 달에 한 번씩 총 3회 아일리아 주사를 투여 받았다. 임상에 참여한 환자들은 기존 습성 황반변성 치료를 받은 중증 환자들로, 워시아웃 (약물 치료 중단) 기간을 거친 후 본 임상 시험에 참여했다.
이번 중간 보고서는 계획된 총 45명의 피험자 중, 12주간 약물 투여를 완료한 24명 (전체 피험자의 53%, 위약군: 8명, CG-P5 투여군: 7명, 아일리아 투여군: 9명) 을 대상으로 분석한 결과다.
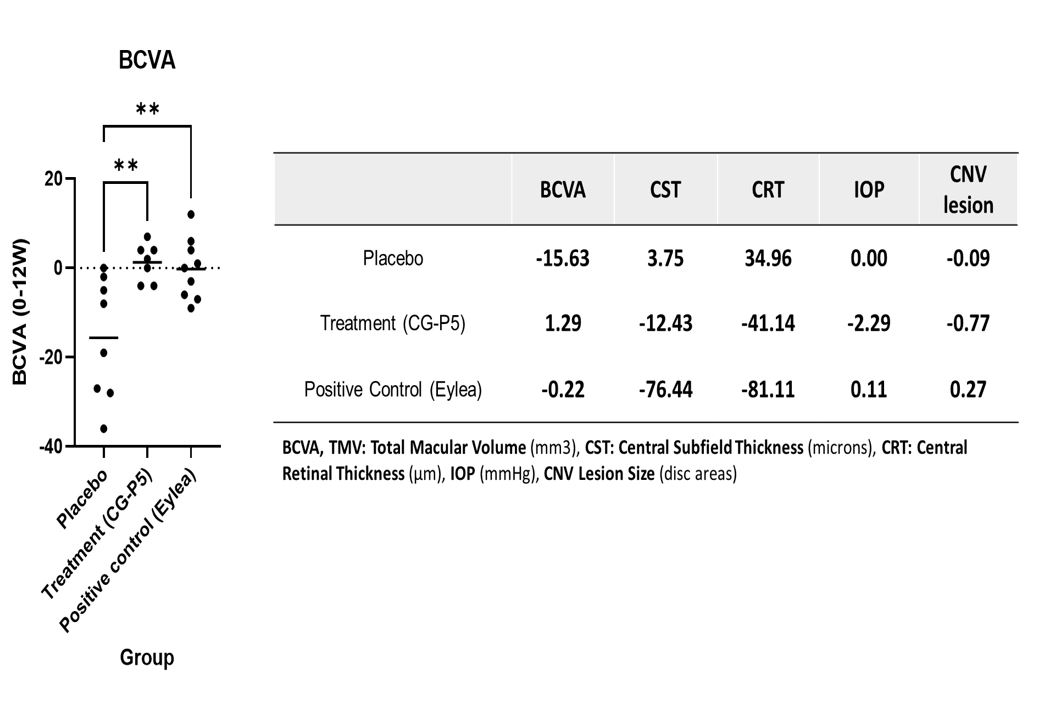
케어젠에 따르면 이번 시험 1차 평가 기준 (Primary endpoint) 은 약물 안전성과 내약성을 확인하기 위한 평가로,약물의 안전성에서는 특별한 이상반응(AE)이 나타나지 않았으며, 내약성은 우수하다는 평가를 받았다. 유효성을 판단하기 위한 2차 평가 항목 (Secondary endpoint)은 최대교정시력(BCVA), 중심망막두께(CRT), 황반중심두께(CST), 그리고 신생 혈관 병변 (CNV Lesion)이 포함됐다.
중간 분석 결과, 위약 투여군에서는 최대교정시력(BCVA)이 -15.63 감소하고 중심망막두께(CRT)는 34.96μm 증가했으며, CST(황반중심두께)는 3.75microns 이 증가해 전반적인 증상이 크게 악화된 것이 관찰됐다. 반면 양성대조군인 아일리아 투여군에서는 BCVA -0.22(위약대비 15글자(3줄)상승), CRT는 -81.11μm 으로 위약군 대비 통계적으로 유의한 효과를 보였으며 CST는 -76.44 microns 감소해 통계적 유의성은 보이지 않았다. 그러나 CNV 병변 크기가 오히려 악화 되는 경향이 확인 됐다.
CG-P5 점안액 투여군에서는 BCVA +1.29 (위약대비 17글자(4줄)상승), CRT는 -41.14 μm 감소로 위약군 대비 통계적으로 유의미한 개선 효과를 보였으며 CNV 병변 크기는 -0.77이 감소해 병변 부위 신생 혈관이 줄어드는 효과도 관찰됐다.
이 임상은 치료 경험이 있는 중증 환자들과 상대적으로 소규모 피험자 수에도 불구하고 양성대조군인 Eylea 와 CG-P5 투여군에서 BCVA와 CRT가 통계적으로 유의미한 개선을 보였으며, 이는 CG-P5의 치료 잠재력을 강력히 뒷받침하는 결과로 해석된다고 회사 측은 설명했다. 특히, 소규모 피험자 수에서도 통계적 유의성이 도출된 점은 CG-P5가 매우 뚜렷한 치료 효과를 보여주었음을 시사한다고 밝혔다.
케어젠 관계자는 "이번 임상 1상 중간 결과는 CG-P5가 기존 주사 치료제 아일리아나 루센티스 대체 치료 옵션으로 발전할 가능성을 보여준다. 이번 중간 보고서는 전체 피험자의 약 53%의 피험자를 대상으로 분석되었기에 최종보고서도 유사한 결과가 나올것이라 기대하고 있다” 며 “현재, 다양한 적응증으로의 확대를 위해 임상 2상의 프로토콜을 준비중"이라고 전했다.
CG-P5는 혈관 내피 성장인자 수용체(VEGFR-2)에 선택적으로 결합하여 맥락막 신생혈관(Choroidal Neovascularization, CNV) 형성을 억제하는 신약 후보물질이다. 기존의 주사제를 대체할 수 있는 점안액 형태로 개발되고 있다.
-
01 코아스템켐온, 오송 공장 제조업 변경허가 ... -
02 셀레믹스,질병청과 인플루엔자-코로나19 전... -
03 렌비마, 간암·자궁내막암 급여 확대…면역항... -
04 블록버스터 의약품 다수 ‘특허절벽’ 임박..... -
05 한미그룹, 2026년 대대적 임원 인사 단행 -
06 리브스메드,'트릴리언 클럽' 진입…상장, 글... -
07 바이오톡스텍-라크, AI 독성병리 자동분석기... -
08 지투지바이오, 수술 후 통증치료제 'GB-6002... -
09 바이오스탠다드, 에스테틱 의료기 필러 ‘미... -
10 휴온스그룹, 2026년 대규모 정기 임원 인사 ...











