뉴스
메디포스트 '카티스템' 글로벌 허가 기대↑…2세대 신약 2상 착수
日 임상 국내 1·2상 결과 인정돼 곧바로 3상…美 3상 파트너사 선정 중
권혁진 기자 │ hjkwon@yakup.com


입력 2022-03-02 06:00 수정 2022.03.03 16:23
글로벌 줄기세포치료제 시장이 가파른 성장세를 나타내고 있다. 2025년까지 약 6조 5천억원 규모로 성장할 전망이다. 국내도 지난 2019년 첨단재생바이오법이 제정되며 줄기세포치료제 개발에 활기를 띠는 모양새다. 특히 메디포스트는 제대혈은행 시장에서 점유율 1위를 기반으로 줄기세포치료제 개발과 사업 다각화를 꾀하고 있어 향후 귀추가 주목된다.
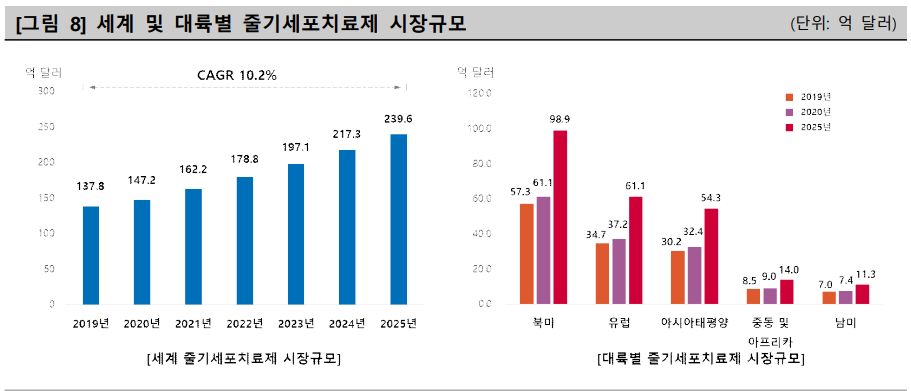
|
▲출처:Mordor Intelligence 'Global Stem Cell Market-Growth'(2020), NICE디앤비
Mordor Intelligence 자료에 따르면, 글로벌 줄기세포치료제 시장은 2019년 137.8억달러(한화 약 4조 5천억원)에서 연평균 10.2%로 성장해 2025년 239.6억달러(약 28조 9천억원) 규모로 성장이 전망됐다. 아시아태평양 시장규모는 2019년 30.2억달러(약 3조 6천억원)에서 2025년 54.3억달러(6조 5천억원)로 연평균 10.9%로 성장할 것으로 전망됐다.
메디포스트는 제대혈유래 줄기세포를 이용한 난치병 신약을 개발 및 판매하는 재생의료 기업이다. 국내 시장점유율 1위 제대혈은행 '셀트리'를 운영 중이며, 셀트리의 제대혈 보관 건수는 2021년 12월 기준 271,165건을 기록했다. 아울러 전년동기대비 15.5% 매출 성장을 나타냈다.
특히 메디포스트는 인프라와 기술력을 바탕으로 제대혈은행, 줄기세포치료제, 건강기능식품을 통해 2021년 3분기 누적 매출액 400.9억원을 기록해 전년동기 대비 358.6억원 보다 11.8%(YoY) 성장을 보였다.
지난 2012년 출시된 줄기세포치료제 '카티스템'은 22,000 vials 이상 누적 판매를 기록, 2020년까지 연평균 43.8%의 급격한 판매량을 기록했다.
또한 메디포스트는 '셀트리'외에도 2019년 줄기세포 배양액 기반 기능성 화장품 개발회사 '셀리노'와 2021년 제대혈 기반 조절 T세포와 NK세포를 이용한 면역세포치료제 개발기업 '이뮤니크'를 설립해 사업 다각화를 진행 중이다.
NICE디앤비 원영빈 선임연구원의 '메디포스트 보고서'에 따르면 메디포스트는 지난 2012년 식품의약품안전처로부터 제대혈 기반 ▲중간엽 줄기세포치료제 '카티스템(CARTISTEM)'을 허가받았으며, 현재 골관절염 치료제로 미국, 일본, 말레이시아 등 해외 판매를 위한 임상 및 허가를 진행 중이다. 또한 ▲기관지폐이형성증 치료제 '뉴모스템(PNEUMOSTEM)', ▲알츠하이머 치료제 '뉴로스템(NEUROSTEM)'을 개발해 기술 상용화를 진행 중이다.
특히 2세대 줄기세포치료제 플랫폼 기술인 스멉셀(SMUP-Cell)을 개발해, ▲주사형 골관절염 치료제 'SMUP-1A-01'와 ▲급성호흡곤란증후군 치료제 및 당뇨병성 신증 치료제 'SMUP-IV-01' 파인프라인을 확보했고, SMUP-IV-01은 임상 2상에 진입했다.
메디포스트의 사업 핵심 기반인 '제대혈'은 산모가 신생아를 분만할 때 분리된 탯줄과 태반 속에 존재하는 혈액으로, 적혈구, 백혈구, 혈소판 등의 혈액세포로 분화하는 줄기세포인 조혈모세포가 다량으로 포함돼 있다.
또한 여러 질병 치료에 사용될 수 있는 다양한 물질을 분비하는 간엽줄기세포와 면역세포가 포함돼 있으며, 신체의 근원이 되는 세포로서 손상된 기능을 재생시킬 수 있는 줄기세포를 다량 함유하고 있다. 이에 따라 여러 난치병 치료 및 신약 개발에 사용되고 있다.
특히 메디포스트는 2세대 줄기세포치료제 생산 플랫폼인 스멉셀(SMUP-Cell) 기술을 구축, 1세대 기술 한계를 극복했다고 평가되고 있다.
메디포스트에 따르면 스멉셀(SMUP-Cell)기술은 작은 크기의 고효능 줄기세포를 선별하는 기술(SMall cell), 반복 계대배양 시 줄기세포능을 유지(UltraPotent)기술, 바이오리액터 적용으로 효율적인 대량생산기술(Scale UP)이다. 이러한 플랫폼 기술을 통해 고효능의 세포를 선별, 분리·배양하고 바이오리액터로 대량생산해 냉동제형으로 유통 및 장기간 보관이 가능하다.
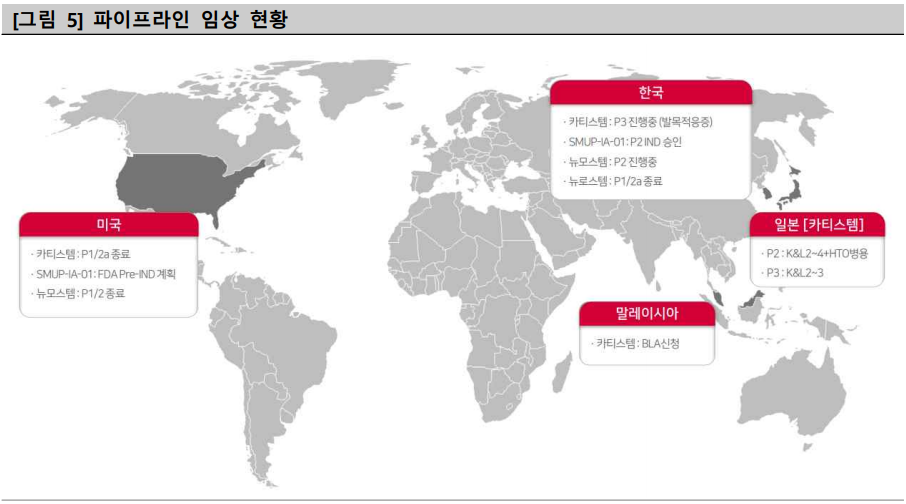
|
▲출처: 메디포스트 IR자료(2022.01), NICE디앤비
메디포스트의 대표 줄기세포치료제 '카티스템'은 지난해 2월 일본 후생노동성으로부터 임상 3상을 승인받았고, 이례적으로 국내 임상시험 결과가 인정돼 바로 임상 3상에 진입했다. 아울러 지난해 3월 말레이시아에서도 국내 임상시험 결과가 인정돼 국립의약품규제기관에 정식 품목허가를 신청했으며, 현재 검토 중으로 알려졌다. 이에 따라 신속한 시장 진입과 아세안지역 거점을 마련했다는 평가다.
특히 메디포스트 관계자는 “카티스템은 지난 2018년부터 미국에서 임상 1상을 진행해, 현재 임상 2상을 마친 상태며, 올해 임상 3상 진입을 목표로 파트너사를 선정하고 있다”고 전했다.
또한 골관절염 2세대 줄기세포치료제 'SMUP-IA-01'은 지난 2020년 말 국내에서 임상 1상이 완료됐으며, 현재 임상 2상이 진행 중이다.
메디포스트에 따르면 'SMUP-IA-01'의 임상 1상은 경증 및 중등증의 환자를 대상으로 6개월간의 안전성과 탐색적 유효성을 평가했으며, 안전성 부문에서는 중대한 이상반응(SAE)과 중대한 약물이상반응(SADR)이 확인되지 않았다. 유효성 부문에서는 모든 그룹에서 평균적으로 약물투약 전과 대비해 투약 후 6개월 시점의 무릎 통증 및 강직성, 신체기능의 경과별 개선 정도(WOMAC) 등의 총점 변화량이 개선이 확인됐다. 아울러 주관적 통증평가(100mm VAS) 변화량과, 주관적 무릎 기능 평가(IKDC score) 변화량도 모두 유의미한 개선을 나타냈다.
이 결과를 바탕으로 지난해 10월 국내 임상 2상이 승인됐으며, 서울대학교병원 본원에서 경증 및 중등증의 무릎 골관절염 환자 총 90명을 대상으로 진행된다. 해당 임상은 무릎 관절강 내에 SMUP-IA-01을 1회 주사 투약 후, 1년간의 관찰 기간을 통해 안전성과 탐색적 유효성을 평가하며, 임상 3상을 위한 최적의 용량도 확인할 계획이다.
나이스디앤비 원영빈 선임연구원은 보고서를 통해 “메디포스트는 전체 사업부문이 동반 성장해 지난해 역대 최대 매출이 전망된다”라며 “줄기세포치료제의 원활한 공급을 위한 GMP 제조소 증설과 계열사를 통한 기능성 화장품 및 면역세포치료제 개발 등 사업 다각화에 따라 지속적인 성장이 기대된다”고 전했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "알테오젠 이을 신흥강자 떴다" 판 흔드는 ... -
02 메디컬에이아이 '의료 AI' 국가전략기술 확인 -
03 "과학자 2700명 모였다" 한국분자·세포생물... -
04 GC녹십자 창립 58주년, ”도전 정신으로 미래... -
05 싸토리우스, 10월 '바이오 DSP 심포지엄' 개... -
06 K-바이오랩허브사업추진단, 첨단재생의료산... -
07 SK바이오사이언스, 영유아 RSV 예방 항체주... -
08 셀트리온, UEGW 2025서 ‘램시마SC’ 장기 임... -
09 알리코제약, '알듀카정' 앞세워 650억 고... -
10 SK바이오팜, 역대 최대 실적 기틀 마련 미국...











