뉴스
식약처, "국내 자가검사키트 허가기준 해외보다 까다로워"
"해외 규제기관보다 높은 수준 성능 입증위한 임상시험 기준 제시"
최윤수 기자 │ jjysc0229@yakup.com


입력 2022-02-18 21:20

|
식품의약품안전처(처장 김강립)는 국내 코로나19 자가검사키트가 해외 규제기관보다 높은 수준의 성능을 입증하도록 임상시험 기준을 제시하여 허가하고 있다고 전했다.
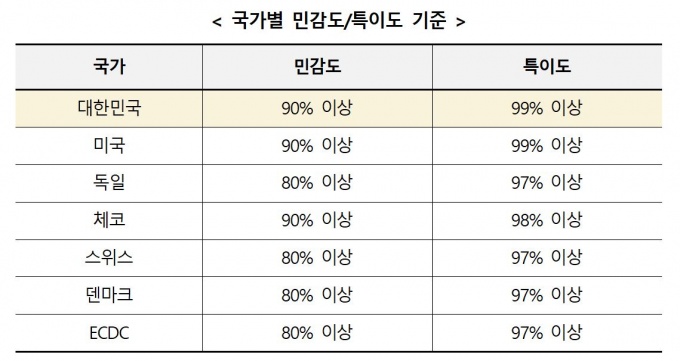
식약처의 허가기준을 살펴보면, 민감도 90% 이상·특이도 99% 이상의 자가검사키트에 대해 허가를 내리고 있으며, 이는 해외에서도 가장 높은 정확도를 요구하고 있는 미국과 같은 기준이다.
민감도는 질병이 있는 환자 중 검사결과가 양성으로 나타날 확률이며, 특이도는 질병이 없는 환자 중 검사결과가 음성으로 나타날 확률을 의미한다.
|
식약처는 코로나19 자가검사키트 허가기준의 임상시험 규모는 해외 규제기관과 비교했을 때 동등하거나 더 많은 임상시험 대상자를 요구하고 있다고 설명했다. 임상시험 대상자중 확진자, 비확진자 비율은 대략 1:2로 설계되었고, 확진자 중 무증상자·초기 감염자를 30% 포함해 성능을 평가하고 있다.
또한 실제 검사 현장에서는 감염 여부를 모르는 사람을 대상으로 검사가 진행되고, 감염 상황에 따라 양성예측도가 달라질 수 있다는 것이 임상시험과 다른 점이라고 전했다.
아울러 국내에서 허가된 자가검사키트 중 일부 제품은 미국, 캐나다 등 해외 규제기관에서 긴급사용 승인되는 등 국제 사회에서도 성능을 인정받고 있다고 설명했다.
실제로 에스디바이오센서, 휴마시스의 자가검사키트는 미국에서 긴급사용 승인을 받은 바 있으며, 수젠텍의 경우 캐나다에서 긴급사용 승인을 받은 바 있다.
식약처는 "자가검사키트의 정확도를 높이기 위해서는 제품에 첨부된 사용설명서를 꼼꼼히 읽고 키트를 올바르게 사용하는 것이 중요하다"며 "특히, 15분~30분의 검사시간을 반드시 지키는 것이 매우 중요하며, 키트에 표시된 대조선(C)이 먼저 진하게 나타나고 검사선(T)에 결과가 나오지 않더라도 나중에 검사선(T)이 나올 수 있으므로 검사시간이 모두 지난 후에 최종 결과를 확인해야 한다"고 강조했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "알테오젠 이을 신흥강자 떴다" 판 흔드는 ... -
02 메디컬에이아이 '의료 AI' 국가전략기술 확인 -
03 "과학자 2700명 모였다" 한국분자·세포생물... -
04 GC녹십자 창립 58주년, ”도전 정신으로 미래... -
05 싸토리우스, 10월 '바이오 DSP 심포지엄' 개... -
06 K-바이오랩허브사업추진단, 첨단재생의료산... -
07 SK바이오사이언스, 영유아 RSV 예방 항체주... -
08 셀트리온, UEGW 2025서 ‘램시마SC’ 장기 임... -
09 알리코제약, '알듀카정' 앞세워 650억 고... -
10 SK바이오팜, 역대 최대 실적 기틀 마련 미국...











