뉴스
'코박스 퍼실러티' 국민 20%접종 백신 850억원 선납부
나머지 40%분 기업협상도 진행중…국내개발지원 '중앙임상심사위' 도입도
이승덕 기자 │ duck4775@yakup.com


입력 2020-10-30 13:56 수정 2020.10.30 16:23

|
정부가 코로나19 백신 해외도입을 위해 20% 접종 분에 해당하는 850억원 규모의 코박스 퍼실리티 참여 절차를 완료했다.
국내 치료제·백신 개발을 위한 '중앙임상시험심사위원회'도 본격적으로 추진한다는 입장이다.
정부는 30일 코로나19 치료제‧백신 개발 범정부지원위원회(이하 범정부지원위원회) 회의를 열어 그동안의 추진 상황을 점검하고, △코로나19 해외 백신 도입 추진 현황 및 계획 △코로나19 치료제․백신 임상시험 지원방안 △과학기술 출연(연) 연구성과의 방역 현장 적용 추진(안)에 대해 논의했다.
'해외개발 백신 국내 도입 추진'과 관련, 정부는 1단계로 올해 말까지 코박스 퍼실러티(COVAX Facility) 참여 및 글로벌 백신 개발 선두 기업과의 협상을 통해 전국민 60%(약 3,000만 명)가 접종 가능한 백신 확보를 추진한다는 계획을 밝힌 바 있다.
이에 정부는 우선 전 국민 20%(약 1,000만 명)가 접종 가능한 백신 확보를 위해 지난 9일 세계백신면역연합(GAVI)와 구매약정서를 체결하고, 선입금(약 850억원)을 납부하는 등 코박스 퍼실러티(COVAX Facility) 참여 절차는 완료했다고 밝혔다.
나머지 국민 40%(약 2,000만 명)가 접종가능한 백신 확보를 위해 국제(글로벌) 기업과의 협상도 조속히 마무리한다는 계획이다.
선구매 백신은 안전성·유효성 검토 결과, 가격, 기반(플랫폼), 공급 시기 등을 고려해 전문가 의견 수렴 등을 거쳐 결정할 계획이다.
코박스 퍼실리티는 2021년 말까지 전 인구의 20%까지 백신 균등 공급 목표로 세계보건기구(WHO), 감염병혁신연합(CEPI, 백신개발), 세계백신면역연합(GAVI, 백신공급)을 중심으로 추진되고 있는 다국가 연합체이다.
'코로나19 치료제·백신 임상시험 지원 방안'으로는 이에 정부는 임상시험 비용을 지원(’20년 940억 원)하고, 국가감염병 임상시험센터를 지정(’20.9~)해 기업의 임상시험을 지원하고 있다.
거점병원(임상역량 보유)-감염병 전담병원(환자 확보 용이)간 연합체(컨소시엄)으로 구성, 기업의 임상 시험 진행 지원(국립중앙의료원·아주대병원·경북대병원 등 3개 컨소시엄 운영)중이다.
또한 식품의약품안전처에 전담심사팀을 운영해 임상시험 승인 기간도 당초 30일에서 약물 재창출은 7일, 신약 개발은 15일 이내로 대폭 단축했다.
그런데 오늘 회의에서는 기업들이 안정적 코로나19 방역으로 국내 환자가 적어 임상시험 참여자 모집이 어렵다는 점을 가장 큰 애로사항으로 꼽았으며, 환자가 있는 지방의료원이나 생활치료센터는 임상시험 경험이나 기반이 부족해 시급히 개선이 필요한 것으로 나타났다.
이에 정부는 '치료제는 올해 내, 백신은 내년까지', '최소 1개 이상' 결과 도출을 목표로 유망 기업을 중심으로 임상시험이 조속히 성공할 수 있도록 집중 지원할 계획이다.
먼저 정부는 기업이 애로 사항으로 꼽고 있는 병원 내 임상시험 기반을 긴급히 구축하기로 했다.
병원 내 임상시험심사위원회(IRB)가 신속히 심사를 진행할 수 있도록 표준안(가이드라인)을 마련하고, 다수 병원에서 임상시험 진행 시 국가 지정 심사위원회에서 통합 심사가 가능하도록 '(가칭)중앙임상시험심사위원회(약사법 개정)' 도입도 본격적으로 추진한다.
지방의료원 등 임상시험 참여기관의 실정에 맞도록 연구비 집행 가이드라인(표준안)을 마련하고, 임상시험 참여 의료진에 대한 인건비 지원, 지방의료원 기관 평가 반영 등 유인책(인센티브)도 제공한다.
또한 경증환자가 입원하는 생활치료센터에서 임상시험이 활성화될 수 있도록 임상시험 모형(모델)을 새롭게 구축하고, 향후 신규 센터 설치시 적극 반영하도록 할 계획이다.
임상시험 참여를 희망하는 국민에 대한 정보 제공도 강화한다. 국가임상시험지원재단에 코로나19 임상시험 전용 누리집(홈페이지)를 구축하고, 지방의료원이나 생활치료센터에 입원하는 경우 임상 시험에 대한 정보를 적극적으로 제공할 계획이다.
임상 시험 종료가 임박한 유망 기업에 대해서는 보건복지부 '임상시험지원 TF' 및 식약처 '허가전담심사팀'을 통해 집중 지원하고, '(가칭) 임상연구 상담(컨설팅) 지원단(국가임상시험지원재단)'을 운영해 기업의 부담이 큰 임상 자료 작성이나 결과 분석 지원 등 서비스를 제공한다.
|
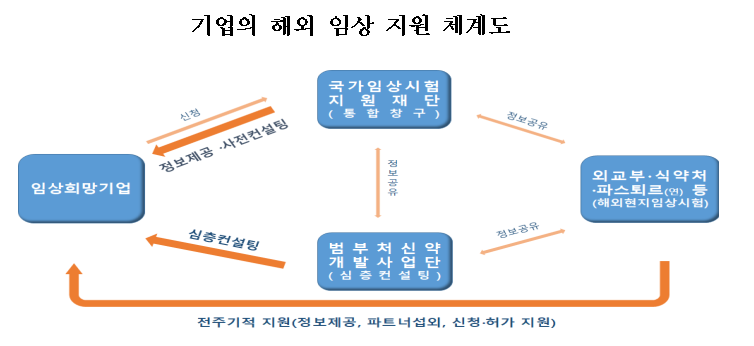
국내 환자 수 부족 등을 고려해 기업의 해외 임상도 적극 지원한다.
'해외임상지원 종합포털' 및 '해외임상시험지원 종합상담센터'를 구축(국가임상시험지원재단)해 희망 기업에 대해 관련 정보 및 상담·컨설팅을 제공하고, 임상 진입 임박 기업에 대해 대면·심층 컨설팅(범부처신약개발사업단)을 통해 맞춤형 해외 임상 전략 수립을 지원한다.
외교부(현지 공관), 식품의약품안전처(한국국제협력단), 과학기술정보통신부(파스퇴르연구소) 등 민관 협력을 통해 기업의 해외 현지 임상시험을 지원하고, 임상시험이 조기에 승인받을 수 있도록 현지 규제 기관과의 협력체계도 강화할 계획이다.
정부는 해외 임상을 희망하는 기업이 한번의 신청으로 여러 기관에서 운영하는 서비스를 통합적으로 받을 수 있도록 국가임상시험지원재단에 '통합 신청 창구'를 운영한다고 밝혔다.
장기적으로 국내 임상 역량이 강화될 수 있도록 임상시험 연구 기반도 지속적으로 확충할 계획이다.
공공백신개발지원센터(질병관리청, ’20년), 한국바이러스기초연구소(과학기술정보통신부, ’21년) 등 연구 지원 기반(인프라)을 조기에 구축하고, 임상시험 설계, 데이터 관리, 조정자(코디네이터) 등 임상시험 전문인력도 2025년까지 약 1만 명을 신규로 양성한다.
또한 임상시험 전문인력에 대해 국가 공인 인증 자격 부여, 정규직 채용 활성화 등 종사자 처우개선도 적극 추진한다.
한편, 이날 회의에는 박능후 보건복지부 장관과 최기영 과학기술정보통신부 장관(공동위원장), 이의경 식품의약품안전처 처장 및 관계부처 차관, 국내 치료제‧백신 분야 전문가 등이 참석했다.
[관련기사]
코로나19 의약품 개발등 2021년 예산안 2,604억원
2020-09-26 11:44
코로나19 백신확보 4,000만 도즈(2천만명분) 우선 확보
2020-08-21 11:05
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 유한양행 1분기 영업익 흑자전환…매출액은 ... -
02 차바이오텍,'CordSTEM-ST' 조기난소부전 임... -
03 클립스비엔씨, MRSA 감염증 예방 백신후보... -
04 이엔셀, 첨단바이오의약품 제조 공급 계약 ... -
05 온코크로스, ASCO서 'AI 대사체 기반 조기 ... -
06 베이진, ‘비원메디슨’으로 상호 변경...글... -
07 코어라인소프트, MS 이어 베링거인겔하임 ... -
08 GC녹십자, 헌터라제 임상3상서 운동능력 개... -
09 인트론바이오, 혁신 ‘로봇 박테리오파지’ 플... -
10 램시마SC, 유럽 전체 점유율 22%.. 4년 만에...











