조직생검 결과값과 연계된 F2-F3 MASH 환자군에 별도 하위그룹 분석
주요지표서 위약군 대비 통계적 유의한 개선 지속- 치료 효과 확인

GLP-1 계열 신약 개발 전문기업 디앤디파마텍(대표 이슬기)은 자체적으로 미국에서 임상 개발 중인 MASH(대사이상 관련 지방간염) 치료제 ‘DD01’의임상 2상 시험에서 MASH와 관련된 주요 항목 24주 2차 평가지표 결과에서 유의미한 효과를 확인 했다고 밝혔다.
DD01은 디앤디파마텍이 자체 개발한 GLP-1 및 글루카곤 수용체를 동시에 타겟하는 장기 지속형 이중 작용제로, 현재 미국에서 MASLD/MASH 환자를 대상으로 48주 투약 임상 2상 시험이 진행 중이다. 디앤디파마텍은 지난 6월, MRI-PDFF로 측정한 12주차 결과에서 지방간이 30% 이상 감소한 환자 비율과 평균 지방간 감소율 모두에서 글로벌 경쟁사 장기 투약(24-72주) 대비 경쟁력 있는 효과를 확인해 이 임상시험 1차 평가지표를 달성했다.
회사는 24주 투약 이후, 2차 평가지표인 섬유화 관련 혈액 바이오마커와 함께 MASH 환자에서 높은 비중으로 동반되는 비만, 당뇨와 관련된 체중 및 혈당 결과를 분석했다. 또 48주 투여 후 확인 예정인 조직생검과 연계해, 임상적으로 주요한 환자군인 F2-F3 단계 섬유화를 동반한 MASH 환자에 대한 하위그룹 분석도 추가로 수행했다.
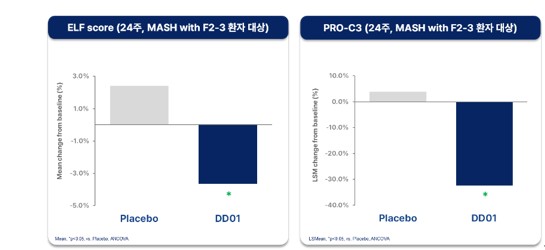
그 결과 12주차에서 의미 있는 개선을 보였던 섬유화 관련 바이오마커(ELF Score, PRO-C3)는 24주차에도 위약군 대비 지속적인 개선을 보여 DD01의 효과가 이어짐을 확인했다. 섬유화 진행여부를 비침습적으로 평가하는 ELF Score는 통계적으로 유의미한 차이를 달성했으며(p<0.02), PRO-C3도 통계적 유의성에 근접한 수준을 나타냈다(p=0.06). 특히 임상 및 허가 관점에서 중요한 치료 대상으로 간주되는 F2-F3단계 섬유화를 동반한 MASH 환자군을 대상으로 한 하위 그룹 분석에서는, ELF Score와 PRO-C3 모두에서 통계적으로 유의미한 개선이 확인되었다(p<0.05).
|
이와 관련해 회사는 “핵심 타깃 환자군 (F2-F3 동반 MASH)에서 확인된 섬유화 관련 바이오마커의 지속적 개선은 48주 투여 후 시행될 간 조직생검에서 긍정적인 결과가 도출될 가능성을 시사한다”고 설명했다. 이번 24주차 분석에서는 12주차에 확인했던 MRI-PDFF 및 MRE 등 영상 기반 평가는 최초 임상 설계에 포함되지 않아 수행되지 않았으며 해당 분석은 향후 48주차에 추가로 진행될 예정이다.
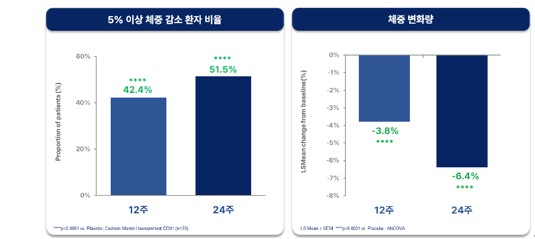
체중 관련 지표에서는 12주차에 전체 투약군 환자의 42.4%에서 체중이 5%이상 감소한 반면, 24주차에는 그 비율이 51.5%로 증가하였다. 또한, 24주 투여 후 전체 투약군 환자의 평균 체중 감소율은 6.4%로 확인되어, MASH 치료제로서 경쟁력 있는 체중 감소 효과를 입증했다. 일반적으로 MASH 환자는 동반 질환이 없는 순수 비만 환자 대비 GLP-1 계열 약물의 체중 감량 효과가 약 30-40% 낮음을 감안하면, DD01의 체중감소 효과는 MASH치료제는 물론 비만 치료제로서도 경쟁력 있는 결과로 해석된다고 회사 측은 밝혔다. (최근 MASH 치료제로 허가 받은 세마글루 타이드(비만 제품명 위고비)는 MASH임상 3상에서 72주 투여 후 10.5%의 체중감소를 보였으며, 순수 비만 환자를 대상으로 한 비만 임상에서는 68주 투여 후 15~17%의 체중감소 효과가 확인됨)
현재 진행 중인 DD01 임상 2상에서는 MASH에 최적화된 40mg용량으로 진행 중이다. 회사는 이미 진행된 DD01 MASH임상1상에서 80mg 고용량군에서 안전성을 확보하면서 40mg대비 높은 체중감소를 보인 것을 감안하면, 향후 비만적응증 임상에서는 80mg을 포함한 고용량 적용을 통해 더욱 우수한 체중감소 효과를 기대할 수 있을 것으로 전망하고 있다.
|
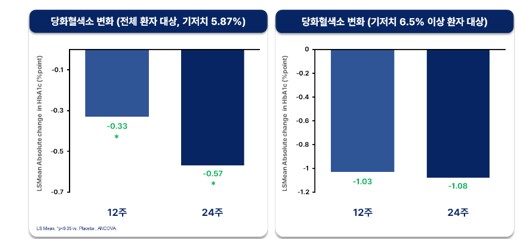
또 회사는 DD01은 GLP‑1/글루카곤 비율을 최적화해 설계된 만큼, MASH 환자에게 흔히 동반되는 당뇨병 관리에도 긍정적 효과도 기대하고 있다.
회사 측에 따르면 이번 24주 분석에서도 12주 결과와 동일하게, DD01 투여군은 위약군 대비 당화혈색소(HbA1c)가 통계적으로 유의하게 감소해 혈당 조절 효과가 지속됨을 확인했다. 특히 당뇨병으로 진단되는 기저 당화혈색소 6.5% 이상의 환자군에서, 24주 투여 후 당화혈색소 변화 결과(-1.08%)는 MASH 환자 대상으로 한 세마글루타이드 2.4mg 72주 투여 임상 결과와 유사한 수준으로 나타났다.
|
한편 회사는 최근 FDA에서 MASH 치료제 허가를 위한 비침습적 바이오마커인 VCTE 도입 검토를 시작함에 따라, 향후 다양한 바이오마커가 치료제 허가 과정에 적극 활용될 것으로 보고 있다.
회사 관계자는 “ DD01 임상2상은 FDA가 검토를 시작한 초음파 기반 VCTE 보다 정확성과 신뢰성이 높은 MRE (MRI기반 간 탄성도 측정법) 분석을 포함하고 있다. MRE는 VCTE와 달리 간 전체를 포괄적으로 측정할 수 있어 보다 정밀한 섬유화 평가가 가능한 방법으로 인정받는다”며 “ 지난 DD01 임상2상 12주 MRE 결과 전체 환자군에서 위약군 대비 통계적으로 유의한 개선이 확인됐으며, 이번에 추가로 수행한 12주차 하위그룹 분석에서 임상적으로 중요한 F2-F3단계 섬유화 환자군에서도 역시 동일하게 통계적 유의성을 확보한 효능을 입증했다”고 밝혔다.
-
01 미국 하원, 2026 국방수권법안 통과...‘생물... -
02 애경산업, 세계화장품학회서 연구성과 2건 발표 -
03 앱클론, 차세대 카티 치료제 '네스페셀' 개... -
04 GC녹십자,독감백신 ‘지씨플루’ 누적 생산량... -
05 마티카바이오랩스,사이알바이오와 CDMO 계약... -
06 이노퓨틱스, 파킨슨병 유전자치료제 1상 임... -
07 키프라임리서치 "ADC 개발 성공, '비임상 독... -
08 'KOREA LIFE SCIENCE WEEK 2025', 9월 30일 ... -
09 메디아나, 전동식 심폐 인공소생기(ACM) 제... -
10 디앤디파마텍, MASH 치료제 'DD01' 미국 임...











