동물실험서 글로벌 블록버스터 휴미라·램시마 대비 우월한 효과 입증


|
염증성 장질환(IBD) 분야에서 기존 치료제 한계를 뛰어넘는 새로운 치료 전략이 주목받고 있다. 킴셀앤진(Korean Innovative Medicinal Cell & Gene)이 개발 중인 ‘리지스틴(Resistin)과 그 수용체 CAP1 차단 항체'가 그 주인공이다.
이 항체는 리지스틴을 직접 타깃해 장 염증 억제뿐 아니라 장상피 세포 보호와 줄기세포 재생까지 3중 보호 작용을 발휘하는 새로운 기전의 바이오 신약이다. 특히 TNF-α 억제제 대비 우수한 조직 보호 효과와 정밀한 작용 메커니즘, 글로벌 시장을 겨냥한 사업 전략까지 갖추면서 '차세대 휴미라'로 점쳐지고 있다.
서울대학교병원 순환기내과 교수이자 킴셀앤진(Korean Innovative Medicinal Cell & Gene)을 창업하고 그 대표를 맡고 있는 김효수 교수는 최근 개최된 ‘제9회 미래의학춘계포럼’에서 ‘리지스틴 항체를 이용한 염증성 장질환 치료제 개발’을 주제로 발표를 했다.
리지스틴은 20년 전에 클로닝된 분자로서 동물실험에서 당뇨병을 유발하는 아디포카인으로 알려져 왔다. 그러나 김효수 교수 연구팀은 지난 15년에 걸친 연구를 통해, 인간에게서는 마우스와 달리 리지스틴이 단핵구에서 분비되며 죽상경화증을 악화시키는 원인물질임을 2011년도 최초로 JACC지에 보고했다.
나아가 리지스틴의 수용체가 CAP1(Cyclase-Associated Protein 1)임을 2014년 ‘CELL METABOLISM’에 최초로 보고했다. 여기에 지속적인 연구를 통해 리지스틴과 캡1의 결합이 전신의 염증을 악화시키고, 세포의 미토콘드리아를 파괴하면서 비만에 의한 당뇨병 발생의 핵심 병태생리임을, 2022년 ‘Metabolism’과 2024년 ‘Research’ 등 권위 있는 국제 학술지를 통해 연달아 발표했다.
염증성 장질환에서 리지스틴 영향은 명확히 나타난다. 2024년 3월 SCI급 국제 학술지 ‘BMC Gastroenterology’에 게재된 ‘염증성 장질환 환자의 혈중 리지스틴 수치: 체계적 문헌고찰 및 메타분석(Circulatory resistin levels in inflammatory bowel disease: a systematic review and meta-analysis)’에 따르면, 염증성 장질환 환자 혈액 내 리지스틴 수치는 건강인 대비 유의하게 높았다.
더 주목할 점은 리지스틴 발현이 질병 활성기뿐만 아니라 관해기(Remission)에도 장 조직 내에서 지속됐다는 사실이다. 이는 TNF-α, IL-1β, IL-6 등 기존 염증 지표들이 회복기에 감소하는 것과는 뚜렷한 차이를 보인다.
김 교수는 “리지스틴은 장 염증 시작과 유지에 모두 관여하는 분자로, 관해기에도 표적 잔존성이 높아 이상적인 치료 타깃”이라며 “이러한 특성 덕분에 리지스틴을 억제하는 치료 전략은 재발 예방 측면에서도 중요한 의미를 지닌다”고 설명했다.
이어 그는 “염증이 겉보기엔 사라진 것처럼 보이는 관해기에도 리지스틴 발현이 계속된다는 것은, 장기적으로 재발 가능성과 직결된다는 뜻”이라며 “염증성 장질환을 근본적으로 치료하기 위해서는 이 시기를 적극적으로 관리할 수 있는 치료제가 반드시 필요하다”고 덧붙였다.
리지스틴 발현, 장 상피 파괴와 줄기세포 손상 유도
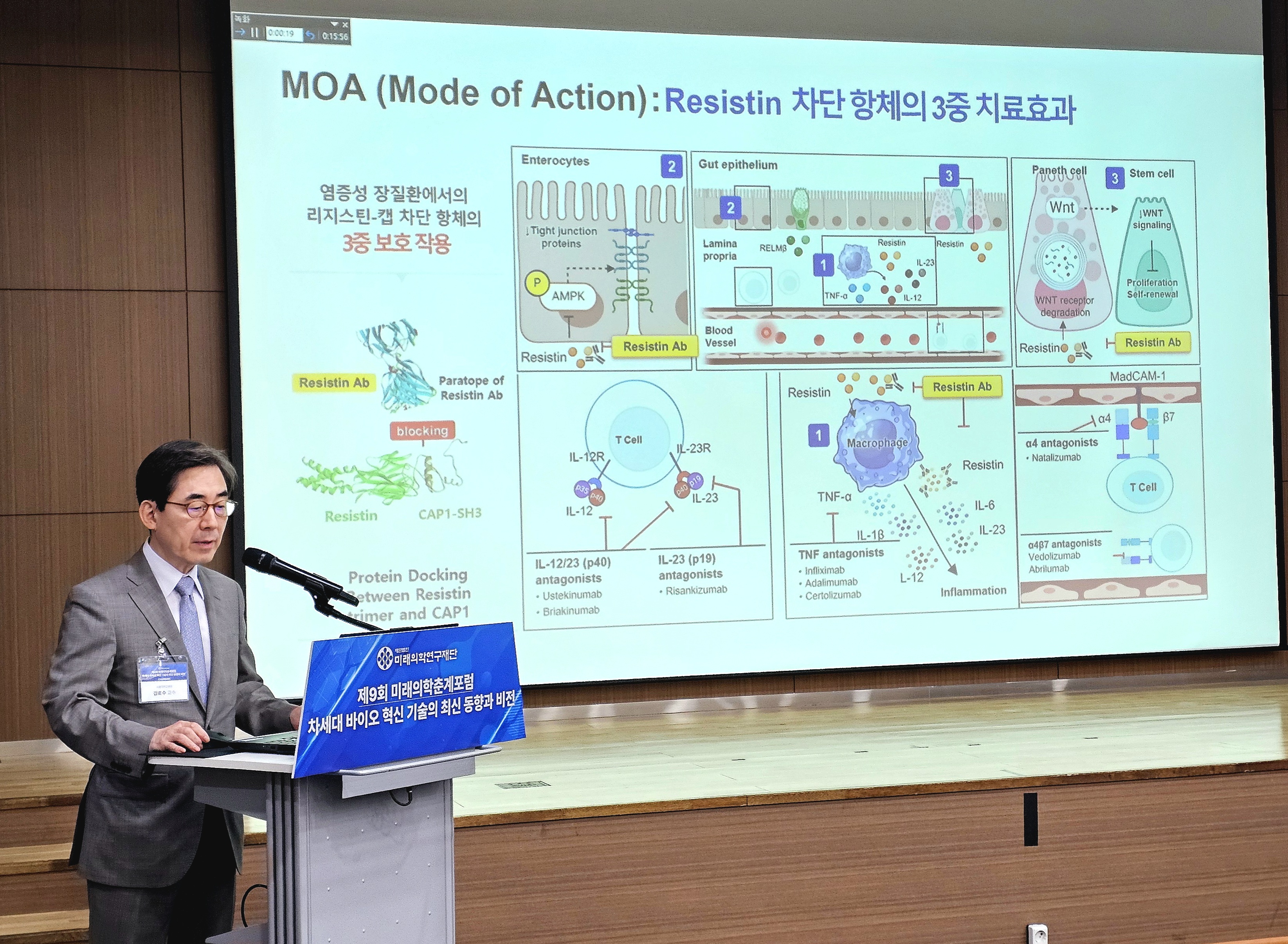
그렇다면 리지스틴은 구체적으로 어떻게 염증성 장질환 병태생리에 관여하는 걸까. 김 교수 연구팀은 다양한 조직 염색 및 동물모델 실험을 통해 리지스틴의 병인 기전을 세 가지로 규명했다.
먼저, 리지스틴은 대식세포 내에서 NFκB(Nuclear Factor kappa-light-chain-enhancer of activated B cells)와 MAPK(Mitogen-Activated Protein Kinase) 신호 경로를 자극해 TNF-α, IL-6, IL-1β 등 주요 염증성 사이토카인 분비를 촉진한다.
다음으로, 장상피세포(Epithelial cell)에서는 AMPK(AMP-activated protein kinase) 활성을 저해함으로써 밀착 연접 단백질(Tight junction Protein) 간의 결합을 약화시키고, 이로 인해 장 장벽의 무결성(Gut barrier integrity)을 손상시킨다.
마지막으로, 파네트세포(Paneth cells)와 장 줄기세포에 작용해 WNT(Wingless/Integrated) 수용체의 분해를 유도하고, 결과적으로 Lgr5(Leucine-rich repeat-containing G protein-coupled receptor 5) 양성 줄기세포의 자가 재생 능력을 억제하는 것으로 나타났다.
이러한 기전은 면역 조절과 조직 재생이 동시에 중요한 염증성 장질환의 병태생리에서, 리지스틴이 단일 인자로서 핵심적인 병인 역할을 수행하고 있음을 보여준다.
김 교수는 “기존 생물학적 제제들이 염증 억제에만 초점을 맞췄다면, 리지스틴 차단 항체는 염증 완화는 물론 장상피 보호, 줄기세포 재생까지 세 가지 기전을 동시에 제어할 수 있다는 점에서 명확한 차별성이 있다”고 설명했다.
이어 그는 “염증성 장질환는 급성과 만성이 반복되는 질환인데, 리지스틴을 차단함으로써 장기적으로 재발 방지와 점막 회복을 동시에 노릴 수 있다”며 “이는 현재 치료제들과는 차원이 다른 접근 방식”이라고 덧붙였다.
|
리지스틴 결손 마우스, DSS 유도 대장염서 생존율 우위
리지스틴 병태생리학적 중요성은 생체 내(in vivo) 모델 연구에서도 일관되게 확인됐다. 김 교수에 따르면, DSS(Dextran Sodium Sulfate)를 이용해 급성 대장염을 유도한 동물실험에서 리지스틴 발현 마우스는 체중 감소, 질병 활성도 지수(DAI), 대장 길이 단축, 조직 손상 등 모든 지표에서 가장 나쁜 예후를 보였다.
반면, 리지스틴 유전자가 제거된 RETN 결손 마우스는 염증 지표가 유의하게 감소했으며, 조직 손상과 장 길이 손실도 현저히 줄어드는 효과가 나타났다.
흥미로운 사실은 리지스틴과 구조적으로 유사한 RELMβ(Resistin-like molecule beta)를 결손시킨 마우스에서는 이와 같은 개선 효과가 나타나지 않았다. 이는 리지스틴 단독 병인 기전 특이성을 뒷받침하는 결과로, RELMβ는 치료 타깃으로 부적절하며 오직 리지스틴만이 명확한 타깃임을 시사한다.
김 교수는 “리지스틴을 제거한 마우스 모델에서는 염증 악화가 억제되고 조직 복구가 촉진되는 결과가 나타났다”면서 “이는 리지스틴이 IBD 병태생리에서 단순한 동반 지표가 아니라 병인 그 자체로 기능하고 있음을 보여주는 결정적인 근거”라고 설명했다.
리지스틴 차단 항체, 휴미라·램시마 대비 우월한 효과 입증
리지스틴 항체는 기존 염증성 장질환 치료제 대비 뛰어난 효능을 보이며 경쟁력을 입증했다. 리지스틴 항체를 휴미라(성분명, Adalimumab)와 동일 조건에서 DSS 유도 대장염 마우스에 투여한 결과, 체중 보존은 2.4배 높았고, 질병 활성도 지수(DAI) 1.7배 감소했다. 염증성 사이토카인 수치는 약 50% 감소하는 등 주요 지표에서 모두 유의한 우위를 나타냈다.
리지스틴 항체는 조직학적 분석에서도 대식세포 침윤 억제, 점액세포 회복, Lgr5 양성 줄기세포 복원 등에서 레미케이드(성분명, Infliximab)대비 더 나은 조직 보호 효과가 확인됐다.
김 교수는 “리지스틴 항체는 TNF-α와 IL-12/23을 동시에 억제하는 복합 기전을 기반으로, 현재 블로버스터인 휴미라를 능가할 우월성을 갖춘 약물”이라며 “염증 억제, 장상피 보호, 줄기세포 재생이라는 3중 보호 기전을 바탕으로, 적응증 확장성과 특허 전략 측면에서도 유리한 위치에 있다”고 말했다.
김 교수팀은 리지스틴-캡1의 결합을 차단하는 인간 단일클론 항체를 도출하기 위해 10년 전부터 파지 디스플레이 라이브러리를 통해서 효과적인 모 항체 5A2을 확보해 세포실험과 동물실험을 통해 그 효과를 입증해왔다.
3년 전 국가신약개발사업단(KDDF) 국책과제(HN21C0524)를 수주해 모항체로부터 LIGHT CHAIN SHUFFLING 기법을 이용, 더 나은 항체 9종을 발굴했다. 그 다음 단계로서 올해 초 KDDF의 국책과제를 수주했으며, 최종적으로 리지스틴 차단 항체 2종을 선정할 예정이다. 현재는 임상 시료 대량 생산이 가능한 수준까지 개발이 이뤄진 상태다.
김 교수는 “리지스틴 차단 항체는 세계 최초 리지스틴 표적 인간화 단일클론 항체이자, 기존 바이오시밀러와는 달리 새로운 작용기전을 가진 계열 내 최초(First-in-Class) 치료제”라며 “글로벌 시장에서 기술적 차별성과 기술이전 가능성을 모두 갖춘 유망 후보물질”이라고 강조했다.

|
-
01 제3회 전문약사 자격시험 실시…443명 응시, ... -
02 한국콜마, 세계적 화학기업 '바스프' 손잡... -
03 '2000억원' 규모 26년 국가신약개발사업 스... -
04 대한약사회, 건보공단 특사경 도입 '찬성'…... -
05 대한약사회, 대웅제약에 '블록형 거점도매 ... -
06 한올바이오, 오송 특화공장 신축 투자 중단 -
07 한국유니온제약,M&A 공고...'스토킹호스' 방... -
08 IVI-질병관리청, 팬데믹 대응 임상시험검체... -
09 GC녹십자, 코로나19 mRNA 백신 국내 임상 1... -
10 마이크로디지탈, 셀트리온 생산공정에 ‘더...











