
|
(주)큐제네틱스(대표 장문석)가 최근 식품의약품안전처로부터 골다공증 치료용 신약 후보물질 ‘QG3030’ 임상 1상 IND 승인을 받았다.
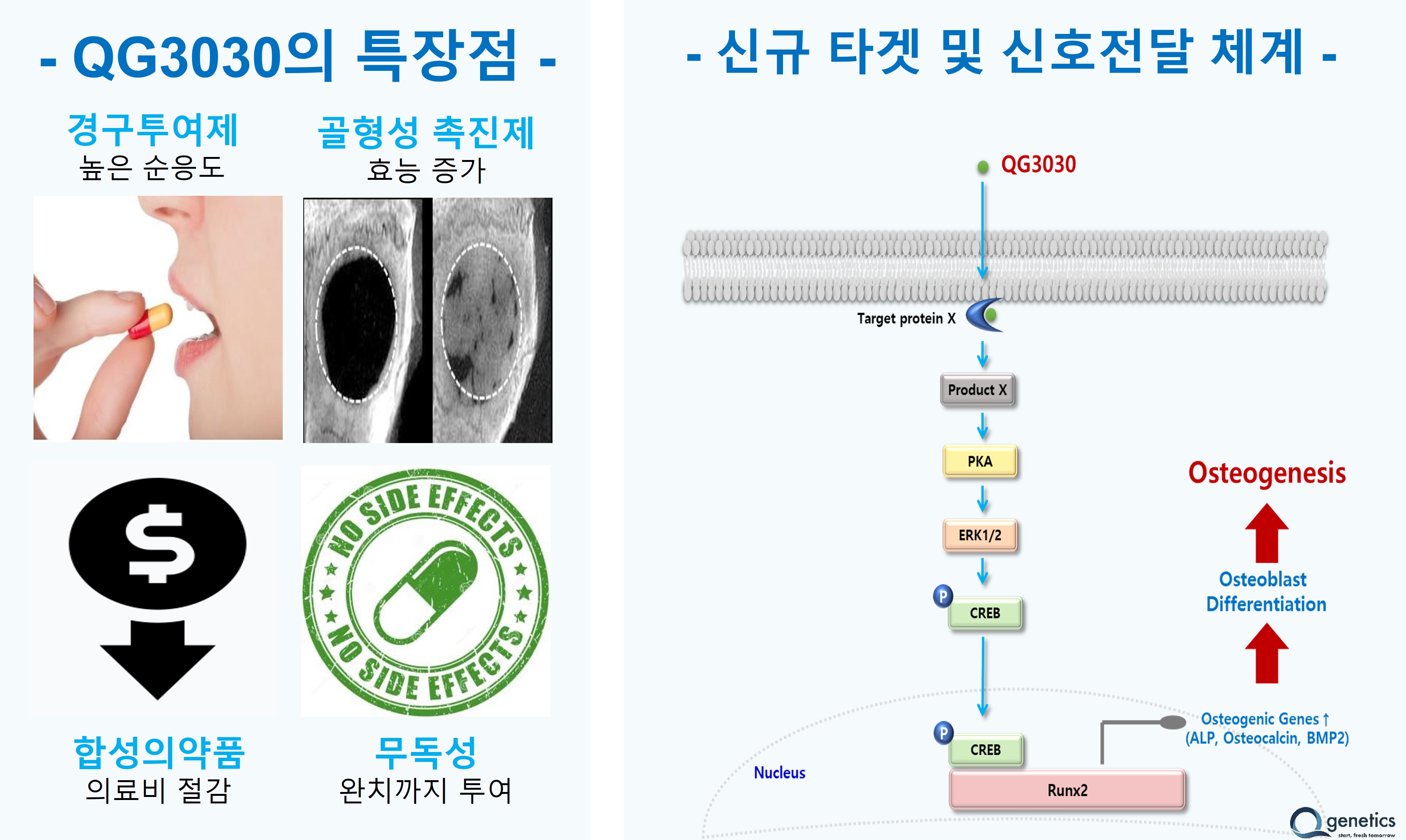
큐제네틱스에 따르면 QG3030은 저분자 합성 화합물로, 중간엽 줄기세포로부터 조골세포로 분화를 촉진함으로써 골밀도를 증가시키며 기존 치료제와 다른 신규 타깃 및 신호전달 기전을 갖고 있다. 이번 임상 1상 승인은 건강한 성인을 대상으로 진행된다.
QG3030은 골형성 촉진 기전으로 Forteo, Evenity보다 우수한 비임상 결과를 토대로 임상 1상 승인 후 임상을 진행 중이라고 회사 측은 설명했다.
큐제네틱스는 2021년 중소벤처기업부 창업기업지원, SBA 유망스타트업, BIG3 혁신성장기업으로 2022년 SBA 하이서울 우수기업인증과 스케일업 팁스에 선정됐다. 현재까지 시리즈 A(2021년, 30억원)와 시리즈 브릿지 B(2023년, 33억원)를 유치했으며, 현재 시리즈 B 투자를 진행 중이다(70억원 규모).
큐제네틱스는 QG3030 임상 1상 완료 후(2025년 9월) 글로벌 거대 제약사에 최소 5,000억 원 규모 기술수출을 목표로 하고 있다. 또 QG3030 적응증을 확대해 비만 치료제임상 2상 완료 후(2027년) 기술 수출, 치조골 이식재와 같은 의료기기(합성골 이식재) 승인 후(2028년) 기술 수출을 목표로 사업을 확장할 계획이다.
큐제네틱스는 장문석 대표는 “지난 21년 서울바이오허브에 입주한 이래 다양한 지원 프로그램에 참여하며 활발한 연구개발 활동을 이어가고 있다”며 “이번 임상 1상 승인은 큐제네틱스 기술력과 연구개발 역량을 인정받은 결과”라고 말했다.
-
01 건보노조, 공단 총무·급여이사 ‘복지부 낙하... -
02 한미약품,멕시코 산페르와 'GLP-1 비만신약-... -
03 셀트리온 '짐펜트라', 역대 최대 처방량 기록 -
04 보령컨슈머헬스케어, 정웅제 신임 대표이사 ... -
05 코아스템켐온, 30억 규모 식약처 'ADC 면역... -
06 셀루메드,유증 자금 합의금 상환 착수..기압... -
07 티앤알바이오팹, ‘세포 블록 조립’ 방식 차... -
08 일동제약, 지난해 매출 7.8%↓5670억원..영업... -
09 [기고] 2025년 개정 의료기기법 총정리-병원... -
10 고세, 폐화장품 활용 환경 촉매 기술 개발 착수











