뉴스
ADC 다음은 나야 나 '프로탁'…①단백질분해표적 기술 '기하급수'
질병 단백질 표적해 치료·질병 막는 새로운 신약개발 기술로 각광
권혁진 기자 │ hjkwon@yakup.com


입력 2023-02-20 06:00 수정 2023.02.21 08:09

|
단백질을 타깃하는 프로탁이 차세대 유망 기술로 떠오르고 있다. 치료적으로나 상업적으로 큰 성공을 거둔 ADC를 이을 차세대 기술로 주목받으면서다.
생물학연구정보센터(BRIC)는 최근 권기문 HK이노엔 연구원(박사)의 'PROTAC, 표적단백질분해(TPD) 및 그 파생기술' 보고서를 발간했다. 보고서엔 PROTAC의 기술 발전과 최근 연구개발 동향, 새로운 치료제로서 가능성에 대한 내용 등이 담겼다.
그동안 기존 약물로 치료가 어려웠던(Undruggable) 단백질 관련 질환들이 PROTAC(Proteolysis Targeting Chimera, 프로탁) 기술의 비약적인 발전으로 새로운 치료제 탄생에 기대가 모이고 있다. 지난 2019년 PROTAC 임상연구가 시작된 이후로 2022년 기준 15건의 임상시험이 진행 중이다.
PROTAC은 단백질 분해 표적 키메라를 가리키는 'TPD(Targeted Protein Degradation)' 기술을 통칭하는 용어로 '대일밴드'와 같이 고유 명사로 사용되고 있다. 정확하게는 미국 아르비나스(Arvinas)의 TPD 플랫폼 기술 명칭이 PROTAC이다.
PROTAC(TPD)은 질병을 유발하는 단백질 또는 분해하고자 하는 단백질을 선택적으로 표적해, 이를 제거하거나 비활성 시키는 기술을 말한다. 즉, 유전자가위 크리스퍼캐스9(CRISPER/Cas9) 또는 ADC(Aantibody-drug Conjugate, 항체약물접합체)와 같이 목표물을 선택적으로 변경, 제거, 타깃해 최종적으로 질병을 치료 또는 발현을 방지하는 신개념 신약개발 기술이다.
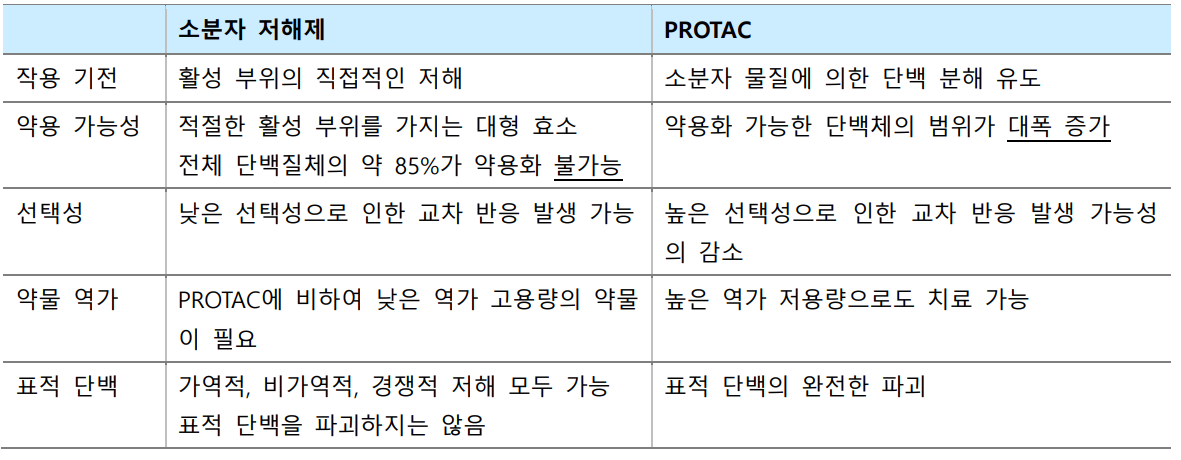
|
△저분자저해제(Small Molecule Inhibitor)와 PROTAC 비교표.(출처: BRIC, 한형진 가톨릭관동대학교 국제성모병원 피부과학과 교수)
기존 저분자저해제(Small Molecule Inhibitor) 기반의 항암제(치료제)는 높은 세포 투과능을 장점으로 오랫동안 암 치료에 효과적으로 사용돼 왔다. 특히 세포 내 단백질까지도 표적으로 삼을 수 있다는 점이 큰 장점으로 여겨져 왔다. 그러나 저분자저해제에는 큰 한계가 존재한다. 대표적으로 타깃하는 단백질의 활성 부위에 결합을 통해 단백질의 기능을 억제해 약효를 나타냈으나, 많은 단백질은 활성 부위가 부족하거나 저해 작용을 적용하기엔 적합하지 않은 활성 부위를 가졌다.
또한 저분자저해제는 치료 효과를 높이기 위해 많은 투여량이 요구된다. 이는 부작용(Off-target)을 유발할 확률이 높다. 특히 표적하는 단백질에 지속적인 저해제의 노출은 해당 단백질의 돌연변이를 유발하고 약물 저항성으로 인한 내성을 일으킨다. 이에 따라 타깃 단백질 억제에 따른 다른 생리활성 경로의 차단, 활성화와 같은 아직 미지의 단백질 작용을 일으킬 수 있다는 위험성이 지속해서 제기돼 왔다.
이러한 기존 저분자저해제 한계를 극복할 수 있도록 고안된 기술이 PROTAC이다. PROTAC은 E3 ligase(E3 리가아제, 결합효소)에 결합할 수 있는 '부위'와 타깃 단백질에 결합할 수 있는 '부위'로 이뤄져 있다. 양 부위를 연결시키는 링커(Linker) 구조로 이뤄진 것이다.
기존 저분자저해제(Small Molecule Inhibitor) 기반의 항암제(치료제)는 높은 세포 투과능을 장점으로 오랫동안 암 치료에 효과적으로 사용돼 왔다. 특히 세포 내 단백질까지도 표적으로 삼을 수 있다는 점이 큰 장점으로 여겨져 왔다. 그러나 저분자저해제에는 큰 한계가 존재한다. 대표적으로 타깃하는 단백질의 활성 부위에 결합을 통해 단백질의 기능을 억제해 약효를 나타냈으나, 많은 단백질은 활성 부위가 부족하거나 저해 작용을 적용하기엔 적합하지 않은 활성 부위를 가졌다.
또한 저분자저해제는 치료 효과를 높이기 위해 많은 투여량이 요구된다. 이는 부작용(Off-target)을 유발할 확률이 높다. 특히 표적하는 단백질에 지속적인 저해제의 노출은 해당 단백질의 돌연변이를 유발하고 약물 저항성으로 인한 내성을 일으킨다. 이에 따라 타깃 단백질 억제에 따른 다른 생리활성 경로의 차단, 활성화와 같은 아직 미지의 단백질 작용을 일으킬 수 있다는 위험성이 지속해서 제기돼 왔다.
이러한 기존 저분자저해제 한계를 극복할 수 있도록 고안된 기술이 PROTAC이다. PROTAC은 E3 ligase(E3 리가아제, 결합효소)에 결합할 수 있는 '부위'와 타깃 단백질에 결합할 수 있는 '부위'로 이뤄져 있다. 양 부위를 연결시키는 링커(Linker) 구조로 이뤄진 것이다.
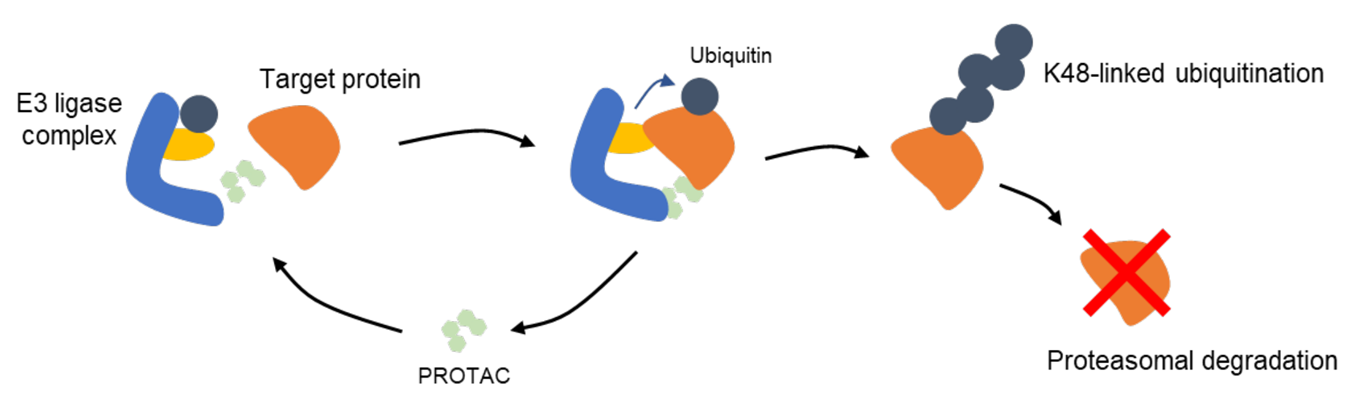
|
△PROTAC 작용기전.(출처: BRIC, 권기문 박사, 'PROTAC, 표적단백질분해(TPD) 및 그 파생기술' 보고서 중 일부 발췌)
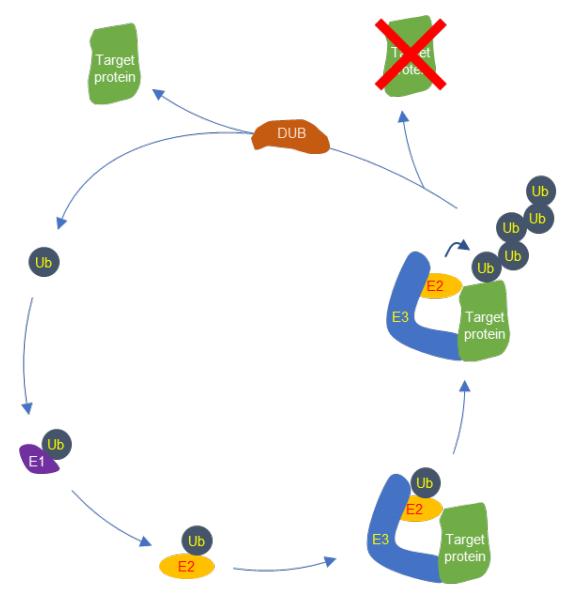
PROTAC은 E3 ligase와 타깃을 붙여 주는 역할을 수행하며, E3 ligase와 표적 단백질이 결합된 이후, 세포 내의 자연적 신호전달 기전을 Hijacking(하이재킹, 강제강탈) 해, 타깃 단백질의 분해를 일으킨다. 이 타깃 단백질 분해에는 Ubiquitin(유비퀴틴, 단백질 분해 단백질) 기반의 단백질 분해 시스템(Ubiquitin-proteasome System, UPS)을 이용하는데, UPS는 정상적인 세포 유지 과정의 일부로, 세포 내 단백질을 분해하는 주요 경로로서 3단계의 연속적인 신호전달(Signaling Cascade)로 이뤄진다. 각 과정은 유비퀴틴 활성효소 E1(E1 Ubiquitin-activating Enzyme), 유비퀴틴 접합효소 E2(E2 Ubiquitin-conjugating Enzyme), E3 ligase로 알려졌다.
E3 ligase는 종류에 따라 다른 방식으로 타깃 단백질을 유비퀴틴화(Ubiquitination) 할 수 있으며, 이 유비퀴틴화 방식에 따라 타깃 단백질의 기능이 달라진다. 특히 타깃 단백질의 분해를 유도하는 K48결합 유비퀴틴화(K48-linked Ubiquitination) 매개 방식을 PROTAC에서 이용함에 따라, 타깃 단백질을 K48결합 유비퀴틴화 시킬 수 있는 E3 ligase가 주로 이용되고 있다.
PROTAC은 현재 3세대에 접어들었으며, 치료제로 사용될 수 있도록 새로운 세대로 개량 과정이 이뤄지고 있다. 3세대 PROTAC은 부작용은 감소시키고 효율은 증대를 가장 큰 목적으로 다양한 장치를 적용해 PROTAC의 활성을 조절하는 방식으로 개발되고 있다.
PROTAC은 E3 ligase와 타깃을 붙여 주는 역할을 수행하며, E3 ligase와 표적 단백질이 결합된 이후, 세포 내의 자연적 신호전달 기전을 Hijacking(하이재킹, 강제강탈) 해, 타깃 단백질의 분해를 일으킨다. 이 타깃 단백질 분해에는 Ubiquitin(유비퀴틴, 단백질 분해 단백질) 기반의 단백질 분해 시스템(Ubiquitin-proteasome System, UPS)을 이용하는데, UPS는 정상적인 세포 유지 과정의 일부로, 세포 내 단백질을 분해하는 주요 경로로서 3단계의 연속적인 신호전달(Signaling Cascade)로 이뤄진다. 각 과정은 유비퀴틴 활성효소 E1(E1 Ubiquitin-activating Enzyme), 유비퀴틴 접합효소 E2(E2 Ubiquitin-conjugating Enzyme), E3 ligase로 알려졌다.
|
PROTAC은 현재 3세대에 접어들었으며, 치료제로 사용될 수 있도록 새로운 세대로 개량 과정이 이뤄지고 있다. 3세대 PROTAC은 부작용은 감소시키고 효율은 증대를 가장 큰 목적으로 다양한 장치를 적용해 PROTAC의 활성을 조절하는 방식으로 개발되고 있다.
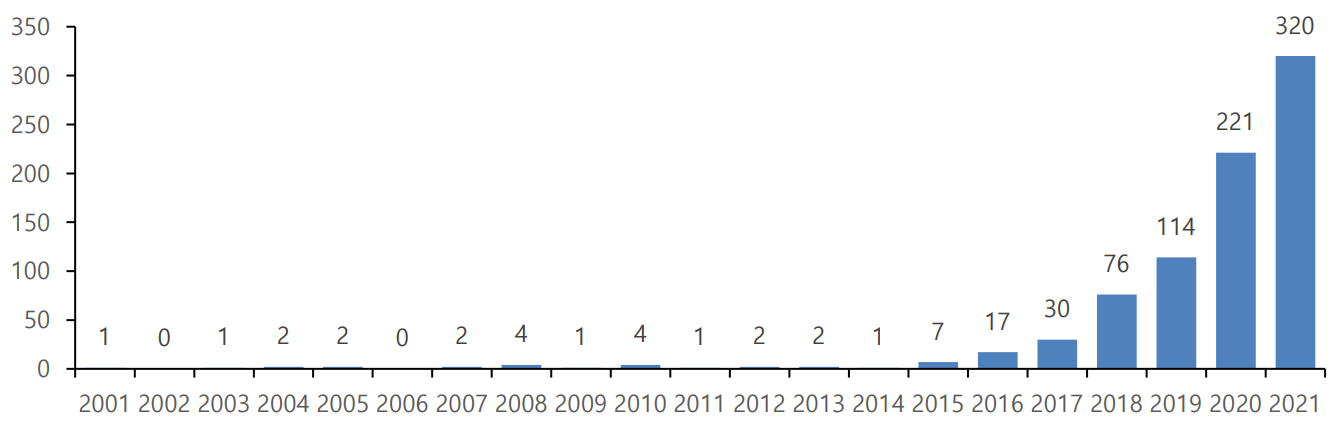
|
△PROTAC 관련 연도별 연구 수(2001-2021).(출처: Li et al., Eur. J. Med. Chem. 2022 및 BRIC 권기문 박사)
학술논문 데이터베이스 웹오브사이언스(Web of Science)에 따르면 PROTAC 연구는 2001년에 처음으로 보고됐고, 2015년 이후로 급격하게 발표 건수가 늘어 2021년을 기준으로 808개의 연구 논문이 발표됐다. 주로 미국과 중국을 중심으로 진행됐다.
또한 PROTAC에 대한 구조 및 실험 데이터가 저장된 온라인 PROTAC-DB에서는 PROTAC의 수가 약 3270개로 집계됐다. 또 E3 ligase 결합, 타깃 단백질 결합 Ligand, Linker(링커)도 각각 82개, 365개, 1501개로 지속 증가하는 추세로 나타났다.
권기문 박사는 "PROTAC과 이를 기반으로 확장돼 연구되고 있는 기술과 약물은 아직 한계를 극복해야 하는 부분이 존재하며, 연구와 발전이 더 필요한 상황"이라고 평가했다.
이어 "그럼에도 PROTAC의 메커니즘으로만 본다면 그동안 개발하지 못했던 좋은 약물을 새롭게 발굴할 가능성이 높다"며 "PROTAC의 가능성이 증명되고 있는 만큼, 더 다양한 방식으로 연구와 임상개발이 확대될 필요가 있다"고 전했다.
학술논문 데이터베이스 웹오브사이언스(Web of Science)에 따르면 PROTAC 연구는 2001년에 처음으로 보고됐고, 2015년 이후로 급격하게 발표 건수가 늘어 2021년을 기준으로 808개의 연구 논문이 발표됐다. 주로 미국과 중국을 중심으로 진행됐다.
또한 PROTAC에 대한 구조 및 실험 데이터가 저장된 온라인 PROTAC-DB에서는 PROTAC의 수가 약 3270개로 집계됐다. 또 E3 ligase 결합, 타깃 단백질 결합 Ligand, Linker(링커)도 각각 82개, 365개, 1501개로 지속 증가하는 추세로 나타났다.
권기문 박사는 "PROTAC과 이를 기반으로 확장돼 연구되고 있는 기술과 약물은 아직 한계를 극복해야 하는 부분이 존재하며, 연구와 발전이 더 필요한 상황"이라고 평가했다.
이어 "그럼에도 PROTAC의 메커니즘으로만 본다면 그동안 개발하지 못했던 좋은 약물을 새롭게 발굴할 가능성이 높다"며 "PROTAC의 가능성이 증명되고 있는 만큼, 더 다양한 방식으로 연구와 임상개발이 확대될 필요가 있다"고 전했다.
[관련기사]
ADC 다음은 나야 나 '프로탁'…②임상시대 개막, 화이자 PICK '아르비나스' 선두
2023-02-21 06:00
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 경기도약 "국민 건강 위협 방치 안 돼…면허 ... -
02 충남약사회 "한약사·창고형 약국 문제 단호... -
03 바디텍메드, 2025년 매출 1620억원…144만 자... -
04 소룩스-아리바이오 6월 합병...바이오 조명-... -
05 위더스제약,안성공장 정제 제조업무 재개..... -
06 글로벌 헬스케어산업 VC 투자,2023년부터 회... -
07 ‘HER2 음성’ 재정의…엔허투가 바꾼 분류 체계 -
08 [약업분석] 현대약품, 매출 9.1%↑·영업익 22... -
09 에이유랩스, 켈로이드 발현 억제 지표 확인.... -
10 현승종합건설, 오캄바이오와 660억원 규모 A...











