뉴스
ADC 약물 내성 극-복, 항암요법에 새로운 패러다임 되나?
3세대 ADC의 약한 독성의 한계…FL118 단독 사용에 충분한 독성 보여 안전성 프로파일까지
김상은 기자 │ kims@yakup.com


입력 2021-11-24 06:00 수정 2021.11.24 10:53
항암물질의 전달체의 기능이 점점 고도화되고 있는 가운데 내성을 보이거나 재발위험이 있는 종양에서도 획기적인 효능을 보이는 후보물질이 개발돼 주목을 끌고 있다.
카이스트 글로벌 기술사업화 센터(GCC)에서 주최하는 제 13회 GCCW(Global Cmmercialization and Workshop; GCCW)에서 23일 피노 바이오 정두영 대표는 ‘Pinot-ADC, 3세대 ADC 개발을 위한 새로운 ADC 플랫폼’를 주제로 현재 자사에서 개발 중인 ADC 물질을 소개했다.

|
정두영 사장은 “항암제 개발에서도 기존 치료제로는 성과를 기대하기 힘든 내성 또는 재발성암의 치료를 목표로 한 신약 파이프라인을 구성하고 있다”며 “이에 접근 방법은 강력한 항암 효과를 낼 수 있는 약물 타겟을 두 개 이상을 동시에 억제하거나 조절할 할 수 있는 즉 ‘다중양리학적 특징을 가지는 새로운 항암제를 고안하는 것”이라고 전했다.
피노 바이오 대표는 “현재 임상 1/2상에서 표적 항암제 NTX301 개발에 성공해 효능과 안전성을 확인했고 이러한 다중양리학적 특징을 가지고 있는 페이로드(payload)를 새롭게 발굴해서 이를 기반으로 새로운 ADC 플랫폼의 개발에 성공했다”고 밝혔다.
표적 항암제 NTX301의 최초 임상결과는 지난 ASCO에서 발표된 바 있는데 백금계 항암제에 내성을 보이는 난소암 및 방광암을 가진 환자 125명을 대상으로 단독 및 백금계 항암제를 병용하는 방식으로 투여했다. 그 결과 데시타빈과 같은 기존 항암제보다 탁월한 효능과 안전성이 확인됐다.
피노 바이오의 ADC 플랫폼은 기존 3세대 ADC 플랫폼과 같은 계통으로 사용할 수 있는 페이로드를 기반으로 하고 있다. 원래 ADC는 암세포 내부의 라이소좀으로 이동해 선택적으로 약물을 방출하기 때문에 암세포만을 선별적으로 사멸시킬 수 있는 기전으로 설계돼있다.
하지만 처음부터 ADC의 개발이 쉬웠던 것은 아니다. 개발 초기에는 페이로드의 독성이 강해 전신 부작용이나 on target toxicity와 같은 문제로 사용에 제한이 있었다. ADC 개발의 첫걸음은 항체의 개발에서 시작해 암세포를 죽일 수 있는 약물의 개발에 이어 링커를 제조할 수 있는 단위로까지 점차 발전하게 됐다.
정 대표는 “한 때 2세대 ADC가 나오던 2010년대를 기점으로 시애틀의 제네틱스나 제넨텍에서 안전한 링커를 확보했다는 발표가 반향을 일으키면서 많은 바이오 회사들이 암세포 안에서만 약물을 방출할 수 있는 ‘링커’ 기술이라면 모든 약물을 시도해볼 수 있겠다는 낙관적인 기대가 만연했다. 하지만 이러한 제약사들이 실상 임상에 진입했을 때는 많은 실패를 거듭했다”고 말했다.
정두영 대표는 “현재는 차별화된 약물의 효능을 낼 수 있는 새로운 페이로드의 발굴이 항암제의 개발 트렌드를 이끌고 있다. 앞으로도 ADC 시장은 급속도로 성장해 기술거래 시장을 주도하는 분야로 성장 할 것”이라고 기대를 모았다.
▶화학요법제에 의존하는 암치료의 현실... FL118 ADC, 새로운 패러다임 될까?
정두영 대표는 “피노바이오는 이런 트렌드에 맞추어서 기존 ADC들의 새로운 페이로드 FL118 또는 피노테칸이라고 부르는 새로운 캄토테신 페이로드를 발굴한데 이어 이를 기반으로 ADC 플랫폼을 구축했다”고 전했다.
2세대 ADC 개발의 고착을 극복한 것은 다이치나 길리어드로 인수되어 있는 이뮤노 메딕스 등이 개발한 3세대 ADH이다. 이들은 ADC는 기존의 1·2세대 ADC와는 다르게 화학적 안전성을 가질 수 있는 이리노테칸이라든가 액사테칸과 같은 항암제를 페이로드로 사용하면 치료용량(Therapeutic window)를 훨씬 넓혀주고 사용량까지 높여 항암 효과를 노릴 수 있도록 했다. 하지만 분명 3세대 ADC가 갖는 약한 독성과 이로 인한 내성과 같은 한계점도 여전히 존재했기에 다른 방안이 필요했다.
정 대표는 “이를 극복하기 위해 먼저 강력하면서도 안전성을 가지고 있는 페이로드가 필요했다”고 이정표를 찍었다. 그는 “캄토테신 유도체 FL118은 기존 이리노테칸의 활성 성분인 SM38보다 5배에서 20배 이상 강력하면서도 전임상 동물 실험에서는 동등한 수준의 안전성을 보이고 있다. 즉 기존 항암제에 비해서 강력하되 동등한 수준으로 안전하기 월등한 Therapeutic Window를 보여주고 있다"고 설명했다.
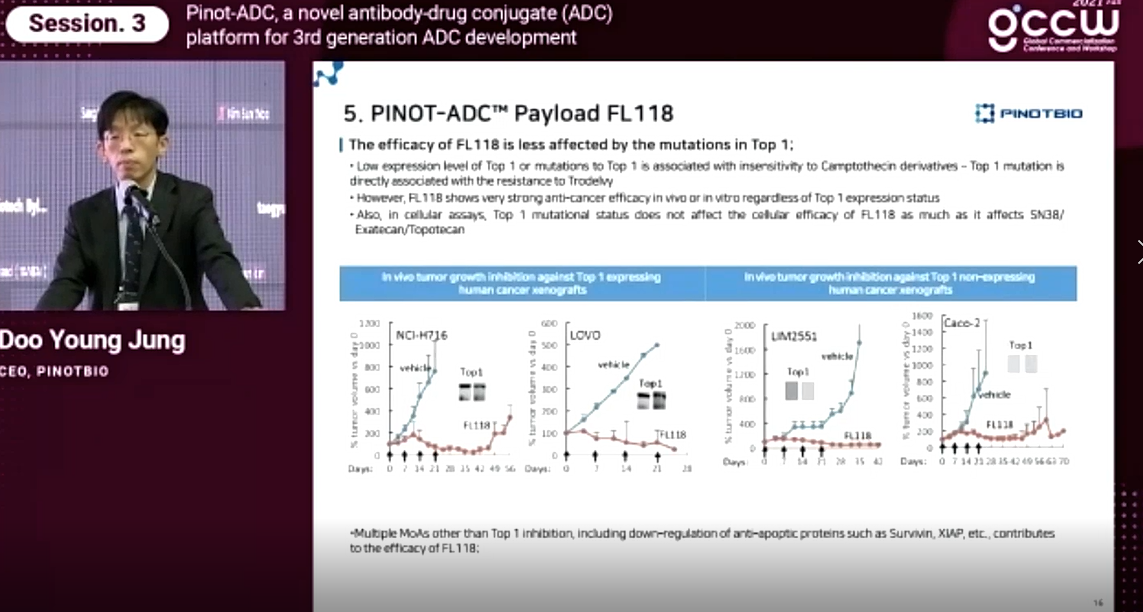
FL118의 또 다른 돌파점은 내성극복이다. 정두영 대표는 “독성이 약한 약물 계열을 사용하다보면 내성 기전이 발생하게 되지만 매우 다행스럽게도 이 페이로드는 그런 내성 기전들에 크게 영향을 받지 않는 특성을 갖는다”고 말했다.
마지막으로는 정 대표는 “FL118이 ADC의 특유한 내성 기전을 극복할 수 있는 장치를 갖추고 있다”고 강조했다. 독성이 강한 약물이 암세포 외부에서 약물이 방출되면 절대 안 되는 문제가 있지만 단독으로도 사용할 수 있는 안전성 프로파일을 갖추고 있기 때문에 약물 전달의 효율성을 극대화한 새로운 링크 시스템을 사용할 수 있다는 것이다.
정두영 대표는 “ADC의 컴포넌트 중에 하나인 FL118 즉 피노테칸은 SN 38에 대비해서 세포에서 암세포를 죽이는 능력이 5배에서 20배 가량 뛰어난 반면 안전성 프로파일은 SN 38과 동등한 수준으로 유지하고 있다”고 설명했다.
암 세포를 동물 모델에서도 암조직을 완전히 없앨 수 있는 굉장히 강력한 효능을 보여주고 있지만 반면 체중 변화를 일정 범위 안으로 유지할 수 있는 굉장히 우수한 치료 용량을 보여주고 있다고 말했다.
FL118이 가지고 있는 내성 극복 특성은 좀 더 세밀하게 국소이성질화효소(topoisomerase 1) 저해제에 대한 세 가지의 내성 기전으로 설명될 수 있다.
먼저, 소위 약물 유출 펌프(drug efflux pumps)라고 하는 물질에 대한 저항성이다. 대부분 topoisomerase 1 저해제들이 ABCG2 단백질이 과발현되면서 활성을 잃게 되어 이러한 저항성을 나타낸다. 대표적으로 이리노테칸을 환자에게 사용하게 되면 이런 많은 환자들에서 ABCG2 단백질이 오버 익스프레이션 되면서 세포 안으로 충분한 양의 이리노테칸이 들어가지 못해서 내성을 발생하게 되는 경우가 많다.
|
정 대표에 따르면 FL118은 ABCG2가 많이 발현되어 있는 셀 라인에서도 포텐셜을 잃지 않고 체내에서도 그대로 일어남으로써 내성 극복이 가능하다는 것이다. 그는 “FL128은 1나노 몰에서 10나노 몰 정도의 낮은 농도로 처리해도 MCl1이라든가 CIAB2와 같이 고형암에서 내성을 유도하는 antiapoptotic 단백질의 발현을 억제하는 것을 확인할 수 있다”고 설명했다.
정 대표는 이리노테칸을 이용한 실제 동물 실험 모델에서 이리노테칸의 내성을 유도한 뒤 처리약물을 FL118로 전환하였을 때 어떤 효능을 보이는지를 확인한 실험을 보여줬다.
정 대표는 “이리노테칸을 처리하다 보면 어느 시점에서는 이렇게 더 이상은 동물에서의 암을 억제하는 효능을 잃게 되어 다시금 종양이 성장한다. 이 때 이리노테칸에서 FL118로 바꿔준다면 다시금 강력한 종양 억제 효과를 다시 얻어낼 수 있다. 이로써 기존 SN38에 기반한 ADC들의 내성 문제를 극복할 수 있는 힌트를 얻은 것이다”라고 말했다.
다음으로는 tporisomrase1 발현량의 저하에 따른 내성 가능성을 극복할 수 있는 기전이다. 정두영 대표는 “내성암에서의 종양 퇴행을 유도하는 데 필요한 양에서의 적어도 2배에서 4배까지 이르는 양의 약물을 효율적으로 전달할 수 있는 방법을 개발했다”며 “페이로드 FL118이 단독으로 사용하여도 충분히 안전한 특성을 가지고 있기 때문에 약물 링커를 설계하는 데 있어서 효율적인 약물 전달체”라고 평가했다.
▶링커 시스템의 개발 후 HER2 및 Trop2 ADC 플랫폼의 개발에 착수
정 대표는 “HER2 대상의 ADC를 개발하기 위해 JMT1이라고 하는 셀라인을 택했는데 이는 굉장히 유용한 내성 모델이기 때문”이라고 설명했다. 만약 ‘Kadsyla’나 ENT 등과 같은 ADC 분자들이 JMT1 세포의 표면에 부착하게 되면 암세포 안으로 들어가지 못하고 암세포 밖에만 머물러 암세포 내에 약물이 방출되지 못하는 내성을 보인다. 이에 HER2 ADC를 5mpk 정도 처리해주면 이렇게 이미 자라있는 종양도 감소 양상을 넘어사멸까지 유도할만큼 강력한 항암 효능을 보이는 것을 확인할 수 있다.
또 다른 물질은 Trop2를 대상으로 하고 있는 ADC PDX-001이다. Trop2는 췌장암, 삼중음성 유방암, 방광암 등과 같이 치료제 개발이 더딘 암에서 예후가 나쁜 환자일수록 Trop2의 발현량이 증가하는 것으로 알려져 있다.
그렇기 때문에 그렇기 때문에 굉장히 예전 한 10년도 넘은 시점부터 이렇게 Trop2는 ADC의 타겟으로 각광 받고 있지만 내성의 문제, 즉 정상세포에서도 Trop2 발현도가 높다는 난제로 화이자나 사노피와 같은 제약사조차 ADC 개발에 뛰어들었지만 실패했다.
결국 현재 Trop2에 적용할 수 있는 ADC는 안전성이 확보된 페이로드만 활용해서 개발이 가능하다는 것이 전문가들의 중론으로 자리 잡고 있다. 정 대표는 “길리어드의 트로델비(Trodelvy) 아스트라제네카의 DS-1062과 같은 Trop2 타깃 ADC이 개발됐으며 현재는 피노바이오의 PDX-001이 기존 약물을 뛰어넘는 충분한 가능성이 있다”고 자신감을 비쳤다.
정두영 대표는 “트로델비는 충분히 높지 않은 전체 반응도가 문제가 되어 효능의 지속력이 떨어진다는 지적이 있고 DS-1062 같은 경우에는 현재 임상 시험이 진행 중이나 다양한 화합물들에 대한 여러 가지 내성 기전으로부터 자유롭지 못한 문제가 있다”고 설명했다.
정 대표에 따르면 피노 바이오는 현재 PDX-001의 최종 후보 물질을 내년 1분기에 선별할 계획이며 이후로 2023년 말 내지는 2024년 초에 저희가 PDX-001에 임상 시험을 개시할 것으로 계획을 세우고 있다.
정두영 대표는 “현재 피노 바이오 외에 국내에 있는 3개의 회사와 영국에 있는 1개 회사와 협업을 맺고 그들이 개발하고 있는 항체와 피노바이오가 제공한 페이로드와 링커 시스템을 결합해 새롭게 후보 물질을 개발하는 연구가 진행되고 있다”고 말했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 메디포스트,2050억 규모 자금조달 계약..미... -
02 종근당-바이엘, 망막 질환 치료제 ‘아일리아... -
03 시민 10명 중 9명 “임신·수유 중 약사 전문... -
04 퓨쳐메디신, MASH 섬유화 신약후보 ‘FM101’ ... -
05 신테카바이오, 파노로스바이오에 '다중표적 ... -
06 이엔셀, 미국서 샤르코마리투스병 신약 ‘EN0... -
07 무약촌 앞세운 안전상비약 확대 기류에…약사... -
08 셀트리온, 안과질환 치료제 '아이덴젤트' 유... -
09 엠브릭스, ‘내비바디 플랫폼’ 미국 특허 등... -
10 오스코텍, 사노피에 1.5조 규모 기술이전 성...











