
|
메지온이 '유데나필'(Udenafil) 적응증 확대에 속도를 내고 있다.
16일 메지온에 따르면 세계 최고 권위 임상병원인 Mayo Clinic 책임 연구자 Fouad Chebib 박사 지휘 하에 유데나필의 ‘상염색체 우성 다낭성 신장 질환’(Autosomal Dominant Polycystic Kidney Disease, ADPKD) 전임상시험을 실험을 통해 효과적으로 낭종 형성을 줄여주는 유데나필 용량 확인, 낭종 형성 억제와 PDE5 inhibition 상관관 관계 입증, 미국 FDA로부터 PKD mouse models에서 신장 낭종을 줄여주고 신장기능을 개선시켜 준다는 사실 입증 확인 등을 진행할 예정이다.
미국 FDA로부터 유데나필의 '폰탄환자들 운동능력 증가' 신약 승인을 받기 위해 추가 임상시험(FUEL-2)을 진행 중인 메지온은, 이와 별도로 다른 질환인 'ADPKD' 치료제로 적응증 확대를 적극 추진해 왔다.
메지온은 이 전임상시험을 통해 유데나필이 ADPKD에 치료 효과가 있음과 유효 용량 범위를 확인한 후 임상시험에 진입할 계획이다.
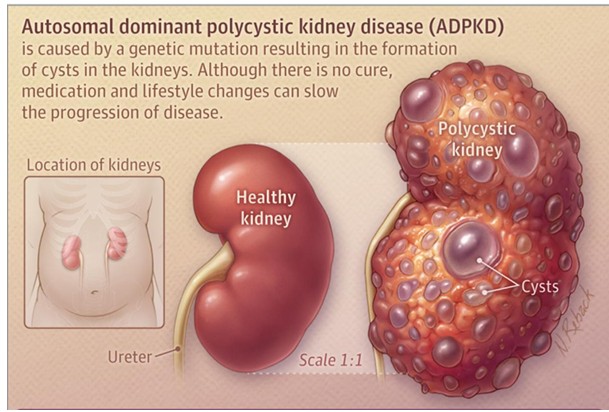
ADPKD는 신장에 수많은 낭종이 생기는 유전 질환으로, 낭종 은 점차 커지면서 신장 조직을 손상시키고 시간이 지남에 따라 신장 기능을 저하시킨다. ADPK는 진행됨에 따라 많은 환자들이 말기에 생존을 위해 투석이나 신장 이식이 필요한, 희귀 신장 질환 중 하나다.
메지온 관계자는 "ADPKD 진행은 비정상적인 cAMP 신호 전달 및 손상된 산화질소(NO) 경로와 관련이 있는 것으로 알려져 있다. 당사 유데나필은 cGMP 신호를 개선해 잠재적으로 cAMP/cGMP 균형을 복원해 낭종 성장과 섬유증을 억제할 것으로 예상하고 있다"며 " 다른 연구들에 따르면 PDE5 inhibitor가 낭종 성장, 염증 및 섬유증을 감소시켜 핵심 ADPKD 병리를 해결할 수 있는 잠재력을 갖고 있음을 보여주고 있다"고 전했다.
한편 ADPKD는 다른 신장 질환에 비해 상대적으로 적은 인구가 영향을 받기 때문에 희귀 질환으로 분류돼 있다. ADPKD 미국 내 환자 수는 대략 14만명으로 추정되며, 상염색체 우성으로 유전되기 때문에 자손에게 질병이 전달될 확률도 50%에 달한다.
현재 FDA가 승인한 ADPKD 치료제는 오츠카제약 Jynarque®(톨밥탄)이 유일하다. 제한적 사용에도 불구하고 2024년 매출 18억 달러를 기록했다. 시장조사 기관 자료에 따르면 2030년대 초반 30억 달러에 달할 것으로 예측된다.
-
01 제3회 전문약사 자격시험 실시…443명 응시, ... -
02 한국콜마, 세계적 화학기업 '바스프' 손잡... -
03 '2000억원' 규모 26년 국가신약개발사업 스... -
04 대한약사회, 건보공단 특사경 도입 '찬성'…... -
05 대한약사회, 대웅제약에 '블록형 거점도매 ... -
06 한올바이오, 오송 특화공장 신축 투자 중단 -
07 한국유니온제약,M&A 공고...'스토킹호스' 방... -
08 IVI-질병관리청, 팬데믹 대응 임상시험검체... -
09 GC녹십자, 코로나19 mRNA 백신 국내 임상 1... -
10 마이크로디지탈, 셀트리온 생산공정에 ‘더...











