
|
의사와 정부 간의 지속적인 갈등이 국내 바이오 신약 개발을 코로나19 팬데믹 수준으로 퇴보(退步)시켰다.
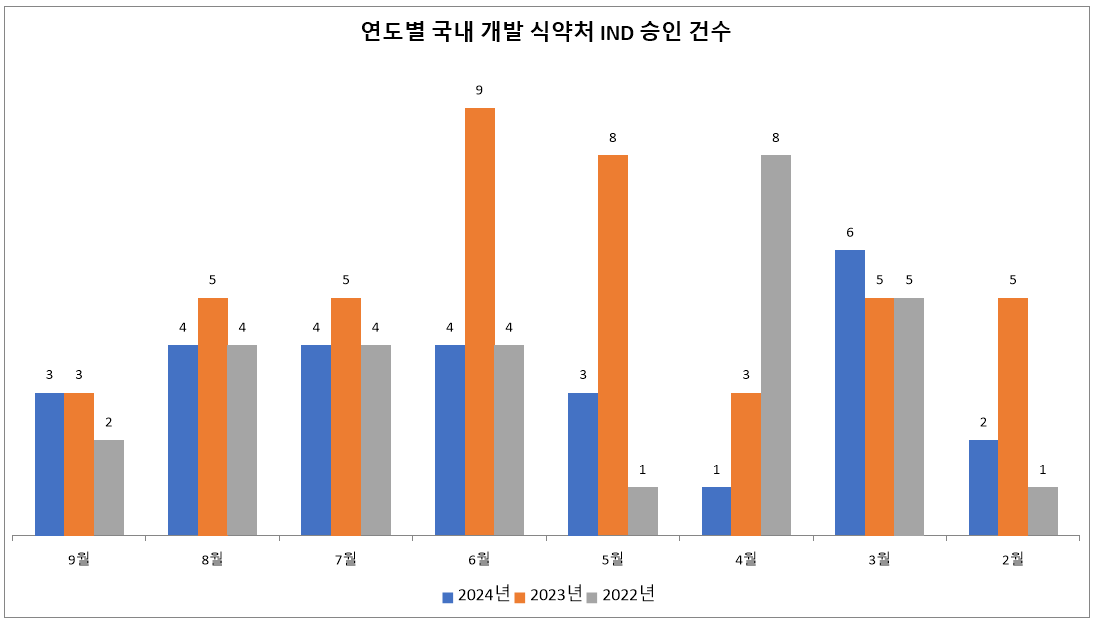
약업닷컴(약업신문)이 6일 한국바이오의약품협회의 산업 동향 정보와 식품의약품안전처의 의약품 통합 정보 시스템 자료를 분석한 결과, 올해 2월부터 9월(1~29일)까지 국내에서 개발된 신약후보 물질 중 식약처로부터 임상시험계획승인(IND)을 받은 건수는 총 27건으로 집계됐다.
이는 지난해 같은 기간 승인된 IND 43건과 비교했을 때보다 무려 37.2% 감소한 수치다. 특히 코로나19 팬데믹으로 인해 대부분 임상시험이 무기한 연기되거나 중단됐던 2022년의 29건보다도 2건이 적은 상황이다. 이는 의정 갈등이 국내 바이오 신약 개발을 코로나19 팬데믹 수준으로 후퇴시켰다는 점을 여실히 보여준다.
특히 최근 3년간 같은 기간 동안 승인된 전체 IND 건수는 거의 비슷한 수준을 유지하고 있다. 즉, 글로벌 빅파마가 주도하는 임상시험은 큰 영향을 받지 않았다는 의미다. 2024년 2월부터 9월까지 전체 IND 승인 건수는 143건, 같은 기간 2023년은 155건, 2022년은 154건으로 큰 차이가 없다.
그렇다면 불안정한 의료계 상황이 국내 기업들에 더 큰 영향을 미치는 이유는 무엇일까. 이에 대해 국내 바이오 신약개발 기업 종사자 A씨, 국내 임상시험수탁기관(CRO) 종사자 B씨, 글로벌 빅파마 종사자 C씨의 의견을 들어봤다.
A씨는 국내 신약후보 물질의 불확실성이 외부 요인에 매우 민감하게 작용한다고 지적했다. 그는 “국내에서 개발 중인 바이오 신약후보 물질들은 대부분 ‘퍼스트 인 클래스(계열 내 최초)’나 ‘베스트 인 클래스(계열 내 최고)’를 목표로 한다”면서 “이는 해당 물질의 안전성을 100% 보장하기 어렵다는 의미로, 임상시험을 진행하는 의사들이 환자의 안전을 보장하기 위해 더욱 많은 시간과 노력을 들여야 함에 따라 외부 요인이 발생할 경우 해당 임상시험을 기피할 수밖에 없다”고 설명했다.
이어 A씨는 “현재도 교수나 의사들은 과중한 업무 속에서 시간을 쪼개 임상시험을 진행하고 있는 실정"이라며 "충분한 시간과 연구 환경이 마련되지 않는 한, 국내 신약개발 임상시험이 안정적으로 유지되기 어렵다”고 덧붙였다.
B씨 역시 A씨의 의견에 공감하면서도 국내 신약후보 물질의 성공 사례가 적은 점도 문제라고 강조했다. 그는 “지난 몇 년간 많은 신약후보 물질들이 임상시험에 진입했으나, 괄목할 만한 성과를 거둔 물질은 많지 않다”며 “성과가 필요한 사람들에게는 국내 개발 신약후보 물질의 임상시험은 매력적이지 않을 것”이라고 말했다.
또한 B씨는 “신약후보 물질의 임상시험을 진행할 수 있는 인프라가 갖춰진 병원과 인력이 적은 것도 문제"라면서 "한국이 임상시험 강국이라 불리지만, 실제로 안정적으로 임상시험을 수행할 수 있는 병원과 인력은 더 많이 필요하다”고 설명했다.
반면 C씨는 글로벌 빅파마 입장에서 국내 임상시험에는 큰 어려움이 없다고 밝혔다. 그는 “비교적 최근에 임상시험이 활성화된 국내 바이오텍과 달리, 글로벌 빅파마는 수십년간 임상시험 전문가들과 탄탄한 네트워크를 구축해왔다"라며 “또한 개발 중인 신약후보 물질에 대한 신뢰성도 매우 높다”고 언급했다. 이어 C씨는 “임상시험이 원활하게 진행될 수 있는 환경을 지원하는 것도 글로벌 빅파마의 임상시험을 선호하는 이유 중 하나”라고 덧붙였다.
-
01 알테오젠, 박순재 대표 사임…전태연 사장 선임 -
02 티디에스팜, 100억 원 규모 생산기지 확충..... -
03 "파킨슨병, 신경 넘어 혈관서 해답 찾다"…'2... -
04 의사인력 추계위 ‘1만8739명 부족’ 전망에 ... -
05 에이비엘바이오, 일라이릴리서 800억원 규모... -
06 SK케미칼-넥스트젠바이오사이언스, 신약 공... -
07 퀀타매트릭스, 자본 360억원 조달....재무리... -
08 '제51회 약국경영대상' 영예의 대상(大賞) ... -
09 2025년 약업신문 바이오헬스 독자 관심 톱20 ㊤ -
10 코아스템켐온, 오송 공장 제조업 변경허가 ...











