
|
21대 대통령 선거가 2주 앞으로 다가온 가운데, 희귀질환‧소아암, 난치 안과질환 등에 대한 세포‧유전자치료의 인프라 개선을 요구하는 국민동의청원이 등장했다. 청원 시작 5일 만에 절반에 가까운 동의를 얻은 만큼 소관위원회에 회부될 수 있을지 주목된다.
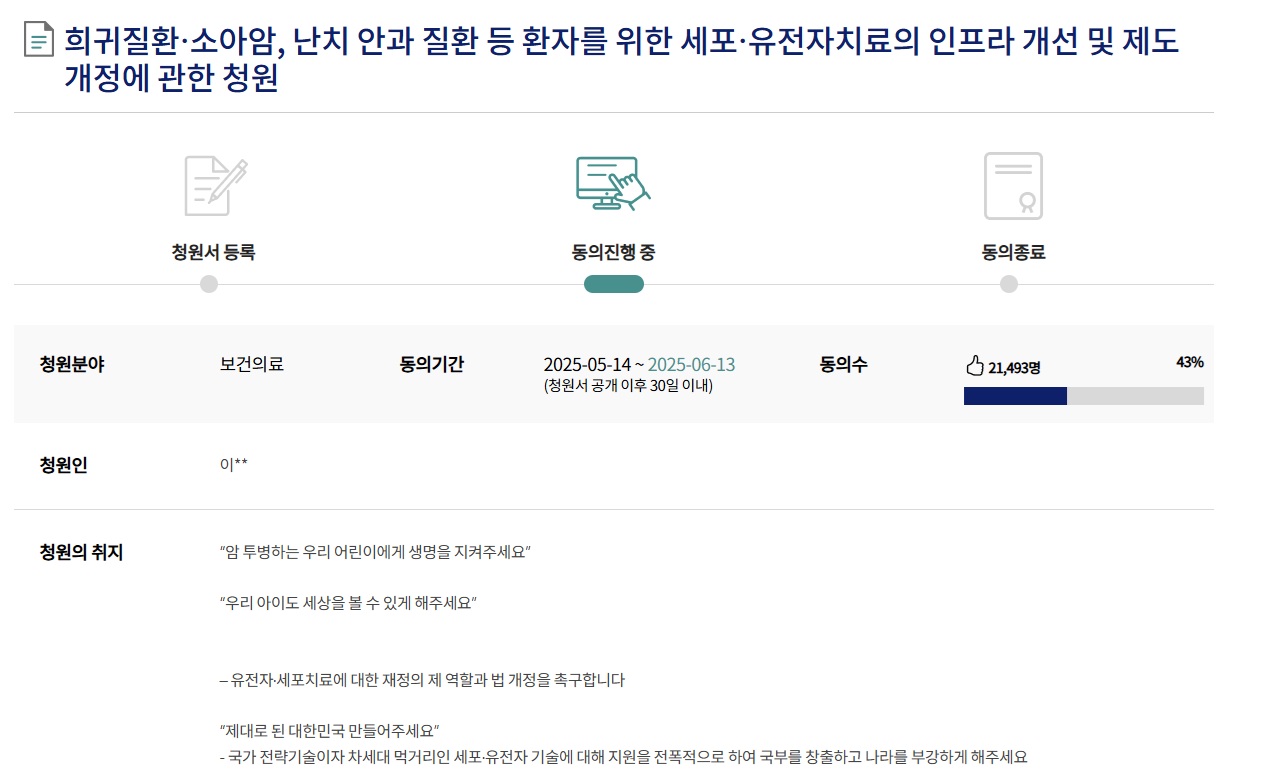
국민동의청원 사이트에 지난 14일 올라온 ‘희귀질환‧소아암, 난치안과질환 등 환자를 위한 세포‧유전자치료의 인프라 개선 및 제도 개정에 관한 청원’은 19일 기준 43%인 2만1500여명의 동의를 얻은 것으로 확인됐다. 다음달 13일까지 청원 동의를 진행하는 만큼 소관위원회 회부 조건인 5만명을 달성할 가능성이 적지 않을 것으로 예상된다.
청원인은 청원 취지에 대해 “유전자‧세포치료에 대한 재정 지원과 법 개정을 촉구한다”며 “국가 전략기술이자 차세대 먹거리인 세포‧유전자 기술에 대해 지원을 전폭적으로 해 국부를 창출하고 나라를 부강하게 해 달라. 또 낯선 희귀유전질환과 소아암, 선천적 시각장애와 싸우는 아이들에게 희망을 달라”고 촉구했다.
청원인은 △유전자‧세포치료센터 설립 촉구(첨단바이오실증센터를 설립해 국내 치료기반 마련) △첨단재생의료법 개정(첨생법 정의 개정과 신속승인을 위한 법 개정) △신생아 눈 종합검사 의무화 및 국가홍보 추진 등 3가지 사항을 요청했다.
이와 관련 소아희귀난치안과질환협회는 지난 15일 ‘첨단재생바이오법 개정 및 R&BD 인프라 구축을 통한 유전자·세포치료 임상연구 지원 정책 제안서’를 최근 더불어민주당과 국민의힘 대선후보 선거대책위원회에 각각 제출했다고 밝히는 등 관련 법 개정을 위한 행보를 보이고 있다.
협회에 따르면 현재 글로벌 시장에서는 졸겐스마, 럭스타나 등 in-vivo 유전자치료제가 허가 및 상용화되고 있으며, 국내에서도 희귀질환 치료의 돌파구로서 관련 기술 개발이 활발히 이뤄지고 있다.
그러나 우리나라의 첨단재생바이오법은 생체 외(ex-vivo) 유전자치료만 임상 연구 대상으로 포함하고 있어 생체 내 유전자치료는 임상 적용이 지연되고 있다는 것.
협회 관계자는 “첨단재생바이오법 개정을 통해 in-vivo 유전자치료를 제도권 내로 포함하고, 동시에 유전자·세포치료제 R&BD센터 구축을 추진해, 임상 연구-치료-산업화까지의 연속적인 지원 체계 마련을 촉구한다”고 강조했다.
소아 희귀난치 질환 환자들의 치료 기회 확대로 삶의 질 향상과 해외 의존적 치료에서 국내 치료로 전환돼 경제적 부담 완화, 선천성 망막질환과 같은 유전성 질환에 대한 근본적인 치료법 제공이 국민 편의뿐만 아니라 첨단의료 산업에 대한 도약의 절호 기회가 될 수 있다는 설명이다.
협회는 우선 첨단재생바이오법 제2조 ‘첨단재생의료’ 정의에 생체 내(in-vivo) 유전자치료를 포함하도록 개정하고, 이에 더해 복지부와 식약처의 이중 승인 문제에 대해 신속 검토로서 승인될 수 있게 법 조항 개정이 필요하다고 설명했다.
한편, 지난해 말에는 희귀병을 앓는 세 살배기 딸의 치료비 46억원을 모금하기 위해 24일간 총 880㎞를 걷는 국토대장정에 나선 전요셉 씨의 사연이 알려지면서, 유전자·세포치료제 R&BD센터 구축이 필요하다는 요구가 제기된 바 있다.
-
01 메디포스트,2050억 규모 자금조달 계약..미... -
02 종근당-바이엘, 망막 질환 치료제 ‘아일리아... -
03 시민 10명 중 9명 “임신·수유 중 약사 전문... -
04 퓨쳐메디신, MASH 섬유화 신약후보 ‘FM101’ ... -
05 신테카바이오, 파노로스바이오에 '다중표적 ... -
06 이엔셀, 미국서 샤르코마리투스병 신약 ‘EN0... -
07 무약촌 앞세운 안전상비약 확대 기류에…약사... -
08 셀트리온, 안과질환 치료제 '아이덴젤트' 유... -
09 엠브릭스, ‘내비바디 플랫폼’ 미국 특허 등... -
10 오스코텍, 사노피에 1.5조 규모 기술이전 성...











