뉴스
허가-평가-협상 연계 1호 약제 '빌베이', 약평위 '재심의' 결정
심평원, 3일 4차 약평위 개최...노바티스 '렉비오' 조건부 수용
전하연 기자 │ hayeon@yakup.com


입력 2025-04-03 19:45
|
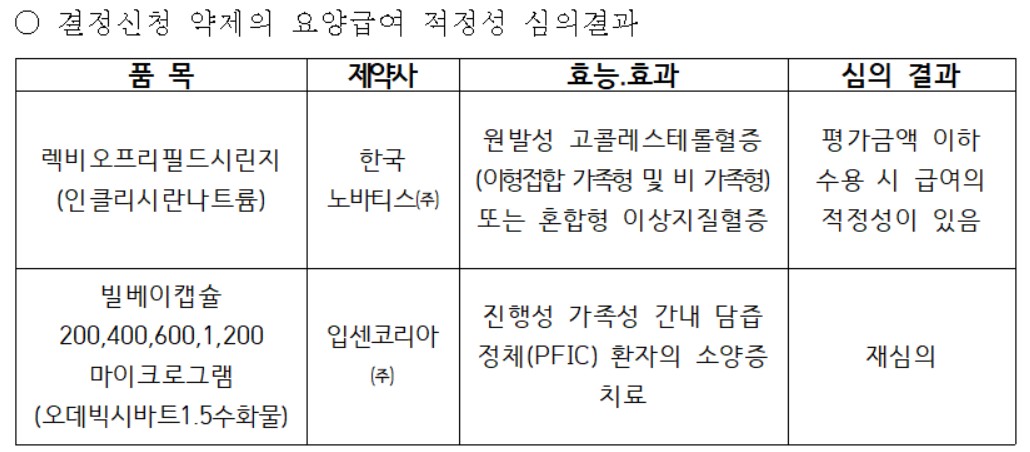
허가-평가-협상 연계 시범사업 1호 대상 약제인 빌베이캡슐이 약제급여평가위원회로부터 재심의 판정을 받았다.
건강보험심사평가원은 3일 제4차 약제급여평가위원회를 개최하고 빌베이캡슐(입센코리아)과 렉비오프리필드시린지(한국 노바티스)의 급여 적정성을 심의했다.
심의 결과 빌베이캡슐은 재심의로 결정돼, 다음 약평위에서 재도전을 노리게 됐다.
빌베이캡슐은 진행성 가족성 간내 담즙 정체(PFIC) 환자의 소양증 치료에 사용되는 약제로서 의약품 허가부터 급여 등재까지의 기간 단축을 위해 도입된 제도인 '허가-평가-협상 병행 시범사업'의 1호 약제로 선정돼 신속 등재 절차를 밟고 있다.
이날 약평위는 원발성 고콜레스테롤혈증(이형접합 가족형 및 비 가족형) 또는 혼합형 이상지질혈증에 급여를 신청한 렉비오프리필드시린지에 대해선 평가금액 이하 수용시 급여 적정성이 있다고 판단했다.
렉비오는 LDL-C을 낮추는 최초의 짧은간섭 RNA(siRNA) 치료제로서 LDL-C를 제거하는 수용체인 PCSK9 단백질을 RNA 간섭으로 차단해 LDL-C를 낮추는 기전을 가진다.
또 타 PCSK9 억제제들의 투여 주기가 2주 또는 4주 간격인 것과 달리 첫 투여 시점으로부터 3개월 뒤 한 번, 그 이후부턴 6개월 마다 투여하면 돼 투약 편의성이 가장 큰 장점으로 꼽힌다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 제3회 전문약사 자격시험 실시…443명 응시, ... -
02 한국콜마, 세계적 화학기업 '바스프' 손잡... -
03 '2000억원' 규모 26년 국가신약개발사업 스... -
04 대한약사회, 건보공단 특사경 도입 '찬성'…... -
05 대한약사회, 대웅제약에 '블록형 거점도매 ... -
06 한올바이오, 오송 특화공장 신축 투자 중단 -
07 한국유니온제약,M&A 공고...'스토킹호스' 방... -
08 IVI-질병관리청, 팬데믹 대응 임상시험검체... -
09 GC녹십자, 코로나19 mRNA 백신 국내 임상 1... -
10 마이크로디지탈, 셀트리온 생산공정에 ‘더...











