허가 시 필요한 GMP 평가자료 통합·조정
위험도 낮은 제조소 현장조사 주기 연장 가능해져


|
식품의약품안전처(처장 오유경)은 의약품 분야 규제혁신을 위한 '의약품 등의 안전에 관한 규칙(총리령)'과 '원료의약품 등록에 관한 규정'·'의약품 제조 및 품질관리에 관한 규정' 등 2개 고시의 개정안을 마련해 5일 입법(행정)예고하고 오는 9월 5일까지 의견을 받는다고 8일 밝혔다.
이번 개정안은 지난 5월에 식약처가 발표한 식의약 규제혁신 3.0 ‘필요해요! 미래’ 테마 과제로써 △국제조화된 규격의 GMP 증명서 제출로 수입 원료의약품 등록 가능 △의약품 허가, GMP 적합판정에 필요한 제출자료를 기존 11종에서 4종으로 통합‧조정 △GMP 적합판정 연장을 위한 확인·조사 체계 개선 등이 담겼다.
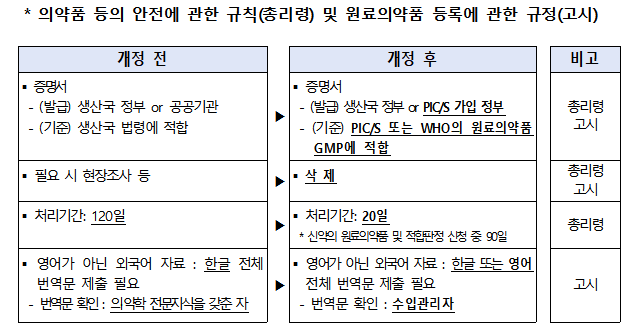
WHO 등 국제조화된 규격의 GMP 증명서가 제출되면 별도 GMP 평가 없이 수입 원료의약품이 등록되며, 그 원료의약품 등록 기간이 120일에서 20일로 단축된다.
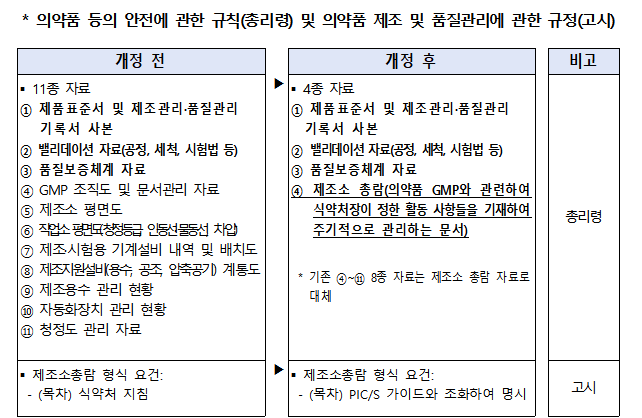
의약품 허가 또는 제조소 적합판정 신청 시 제출해야 하는 기존의 GMP 평가자료 11종 중 제품표준서·제조관리기록서·품질관리기록서, 밸리데이션 자료, 품질보증체계 자료 외 8종 자료를 앞으로 제조소 총람 1종으로 통합‧조정한다.
|
아울러 8종 자료를 제조소 총람으로 대체함에 따라 제조소 총람 정의를 상위 규정(총리령)에 신설하고, 고시에서 제조소 총람 형식 요건을 PIC/S 가이드와 조화해 명확히 규정한다.
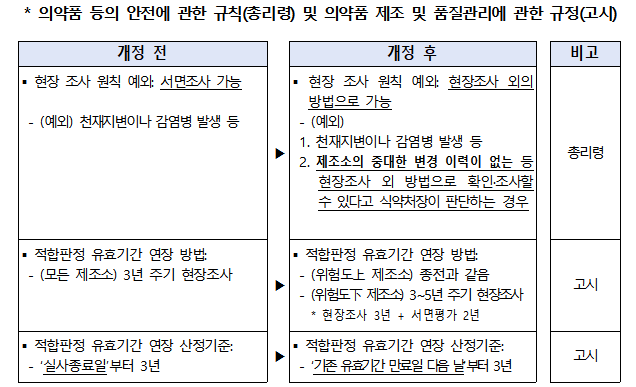
현행 천재지변이나 감염병 유행의 경우에만 현장조사 이외의 방법으로 GMP 적합판정 유효기간(3년)을 연장할 수 있으나, 앞으로는 의약품의 품질·안전성에 영향을 미칠만한 제조소의 중대한 변경이력이 없는 등 식약처장이 인정하는 경우에도 현장조사 외 방법으로 유효기간을 연장할 수 있도록 한다.
|
다만 무균의약품 제조소 등 위험도가 높은 제조소는 종전과 같이 현장조사를 거쳐 GMP 적합판정 유효기간을 3년 연장받을 수 있으며, GMP 적합판정 시 현장조사가 이뤄졌던 제조소가 위험도가 낮은 것으로 평가된 경우 현장조사 외 방법을 통해 유효기간을 2년 연장함으로써 최대 5년 주기로 현장조사를 받을 수 있도록 개선한다.
아울러 GMP 적합판정서 연장 시 유효기간 산정기준을 현행 ‘실사 종료일로부터 3년’에서 앞으로는 ‘기존 유효기간 만료일 다음 날부터 3년’으로 개정해 유효기간 3년을 온전히 보장받을 수 있게 한다.
|
식약처는 "이번 개정이 안전이 확보되는 범위 내에서 불합리한 규제는 적극 검토·개선해 의약품 산업을 활성화함으로써 우리 국민에게 품질이 확보된 안전하고 효과적인 의약품을 신속·안정적으로 공급하는 데 도움이 될 것으로 기대한다"고 밝혔다.
-
01 제니텍 홍성창 회장,'2026년 한국을 이끌 혁... -
02 "제약바이오산업과, 현장 목소리 신속하고 ... -
03 [신년사] 제약바이오헬스산업 경쟁력 강화 ... -
04 [신년사]"약가 개편 등 위기… 290개 회원사 ... -
05 [신년사] "K-바이오, 추격자 넘어 혁신 주체... -
06 [신년사]革故鼎新(혁고정신), 2026년 제약 ... -
07 ★대상 부산오거리약국 황은경약사 -
08 [신년사] "유통의 가치가 재조명되는 전환의... -
09 [신년사] "행동·실천으로 회원과 함께 여는 ... -
10 [신년사] "환자중심 전문약료로 신뢰받는 병...











