뉴스
위탁생동 제조소변경 '자사'만 가능…업계 "수급 우려"
완제의약품 심사 강화, 장용성제제 생동성 추가 등 행정예고
박선혜 기자 │ loveloveslee@yakup.com


입력 2020-12-17 13:17
2021년 의약품 개정안에 따라 위탁생동품목의 제조소 변경 제한(자사전환 제외)이 포함되면서 제약업계에 원료 수급 등에 부담이 될 것으로 보인다.
17일 식품의약품안전처는 '제2회 의약품 안전, 소통·도약 포럼'을 개최하고 '2021년 의약품 허가정책 주요 개선과제'에 관해 발표했다. 이번 개정안은 연내 행정예고, 내년 상반기(6월) 개정이 완료될 예정이다.
|
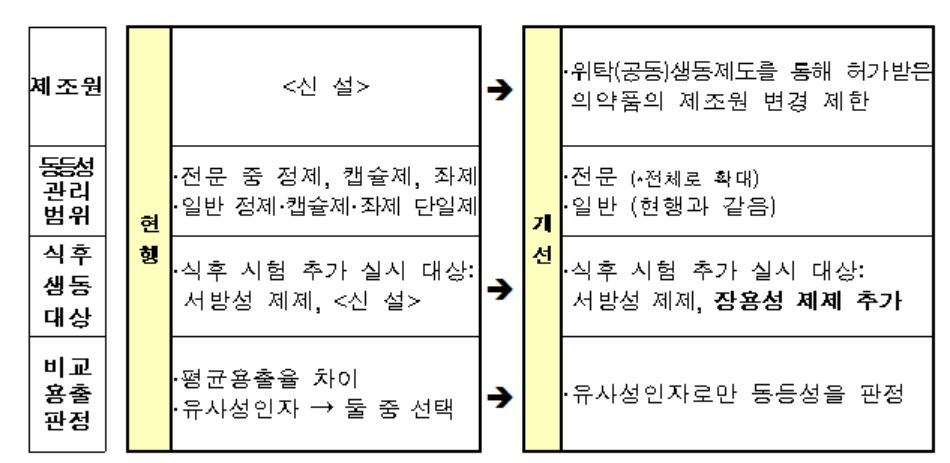
이번 개정안의 주요 정책을 보면 ▲의약품 동등성시험 적용 범위 확대 ▲위탁(공동)생동제도를 통해 허가받은 의약품의 제조원 변경 제한 ▲장용성 제제의 식후 생동성시험 추가 등이다.
우선 식약처는 의약품의 동등성시험 관리 확대를 위해 이전 전문의약품이 정제, 캡슐제, 좌제에만 적용됐으나 향후 전체 의약품으로 적용 범위를 늘렸다.
세부적으로 경구용 제제 전문 의약품은 1년 6개월, 무균제제는 2년 이후, 3년 이후에는 전문의약품 전체에 적용될 예정이다.
위탁(공동)생동제도를 통해 허가받은 의약품의 제조원 변경도 자사 제조소로 전환하는 경우 제외하고는 모두 제한된다.
이에 식약처는 "동일 제품이 시장에서 유통되고 있다는 점에서 위탁생동 품목의 제조소가 바뀔 경우 소비자에게 혼란을 일으키고, 품질에도 신뢰를 미칠 수 있다"고 설명했다.
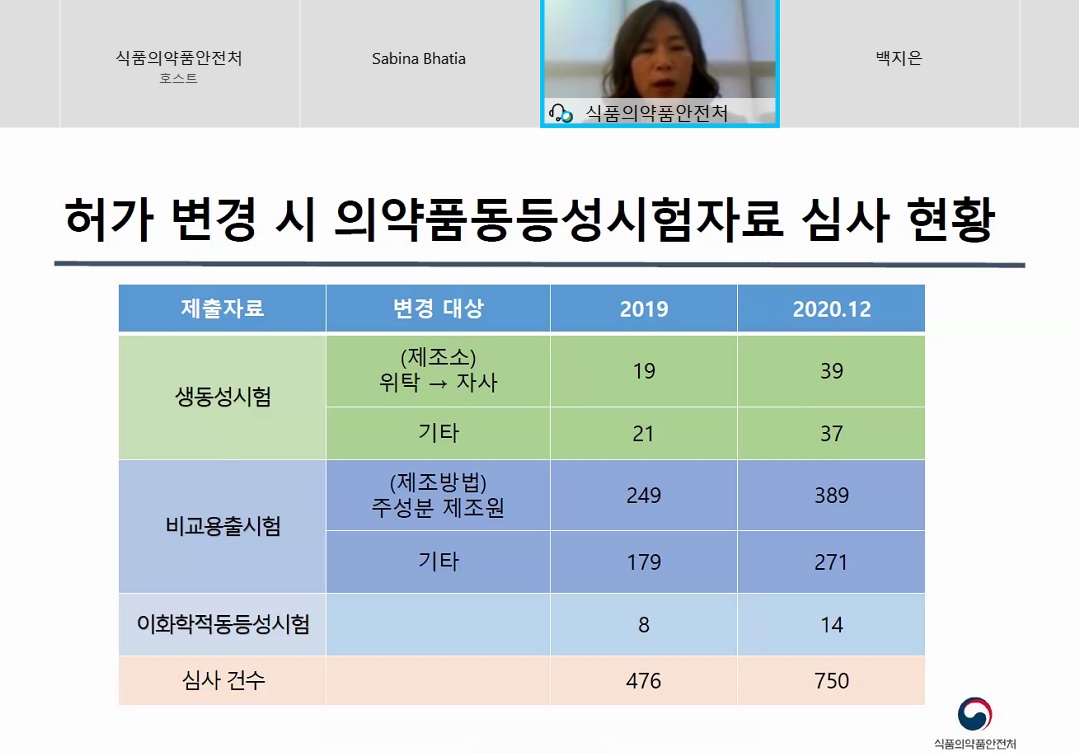
실제로 식약처가 공개한 자료에 따르면 위탁에서 자사제조로 변경해 생동성시험자료를 제출하는 사례가 2019년도에 19건에서 2020년도에 39건으로 증가했다.
또, 주성분 제조원 변경 등의 비교용출시험 자료를 첨부한 사례 역시 2019년 249건에서 389건으로 증가한 것을 확인할 수 있다.
|
이에 식약처는 해당 규제로 원료 등 공급이나 수급에 있어서 제네릭 개발을 하는 업계에 대한 부담이 커질 우려가 있다는 점에 대해서는 차후 의견을 수렴해 검토해보겠다는 입장이다.
이 외에도 식약처는 장용성 제제는 약물이 장에 도달하기 전 위산에 의해 녹거나 방출되는 것을 막아 장에서 흡수되도록 하는 제제 특성상 식후 생동시험이 필요하다 판단, 식후 생동성시험을 추가 적용하도록 한다.
또 비교용출 판정시 평균용출율과 유사성인자 시 둘 중 하나를 선택하는 것에서 앞으로는 유사성인자로만 판정한다.
이는 장용성 및 서방성제제의 경우 유사성 인자기중 (50이상) 및 모든 비교시점에서 평균용출률차이(15% 적용) 등 상이한 부분을 보완하겠다는 취지이다.
향후 식약처는 해외 의약품집 근거 안전성·유효성 면제 규정 삭제와 동시에 일반의약품 표준제조기준 확대도 함께 고려하겠다는 방침이다.
식약처는 "가이드라인을 통해 변경 대상과 변경관리 체계, 제출자료 등을 제시 할 것"이라며 "앞으로도 민관협의체 운영을 통해 지속적으로 보완해 마련할 예정"이라고 전했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 종근당 "위고비 공동 판매한다"…한국노보노... -
02 프로젠, 유럽당뇨병학회서 'PG-102' 전임상·... -
03 약사회, 대통령실 앞 릴레이 시위 돌입…“한... -
04 관세청, K-뷰티 수출 확대 위해 무역 장벽 ... -
05 혁신 비만치료제 개발 가속 '한미약품' 신약... -
06 미국 하원, 2026 국방수권법안 통과...‘생물... -
07 애경산업, 세계화장품학회서 연구성과 2건 발표 -
08 앱클론, 차세대 카티 치료제 '네스페셀' 개... -
09 GC녹십자,독감백신 ‘지씨플루’ 누적 생산량... -
10 마티카바이오랩스,사이알바이오와 CDMO 계약...











