뉴스
식약처, 코로나 진단시약 허가 작성법 등 Q&A 발간
허가절차 및 제출자료 요건 등 관련 질의 사례 설명
박선혜 기자 │ loveloveslee@yakup.com


입력 2020-12-17 09:34 수정 2020.12.17 09:37
식품의약품안전처(김강립 처장)는 체외진단의료기기 등 의료기기 연구‧개발 및 제품화에 도움을 주고자 의료기기 허가심사 질의응답집을 개정‧발간했다.
이번에 발간한 질의응답집은 △체외진단의료기기법에 따른 체외진단의료기기 허가심사에 대한 ‘체외진단의료기기 민원사례 질의응답집’ △체외진단의료기기 외에 의료기기법에 따른 의료기기 허가심사 제도에 대한 ‘의료기기허가심사 사례분석 FAQ’ 등 2종이다.
|
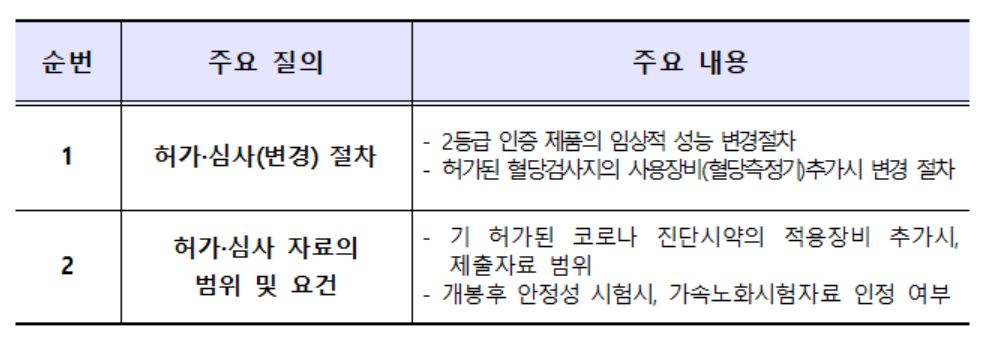
‘체외진단의료기기 민원사례 질의응답집’은 지난 5월 체외진단의료기기법이 시행됨에 따라 변경된 체외진단의료기기 허가‧심사 절차 및 신청 요령 등에 대한 질의‧답변을 소개하고 특히, 코로나19로 제품개발이 활발한 코로나19 진단시약의 허가를 위한 진단시약 성능 시험 자료 등에 대한 작성 요령을 구체적으로 사례를 통해 안내했다.
|
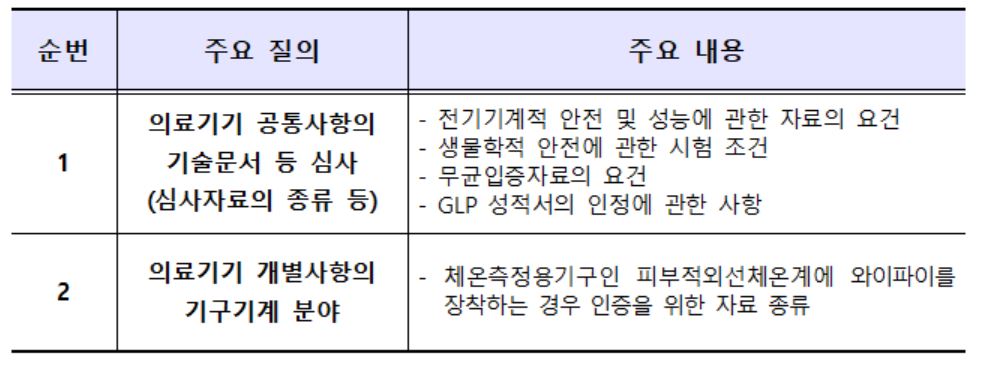
‘의료기기허가심사 사례분석 FAQ’은 ‘전기·기계적 안전 및 성능에 관한 자료’, ‘생물학적 안전에 관한 시험’ 등 의료기기 허가를 위해 필요한 공통의 기술문서에 대한 자료요건 및 작성요령 등을 제시했다.
식약처는 “앞으로도 의료기기 제조·수입업체의 궁금증 해소와 업체 편의성 향상을 위해 의료기기 허가제도 개선 및 개발 동향을 반영한 최신 정보 제공에 적극 노력하겠다”고 말했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 종근당 "위고비 공동 판매한다"…한국노보노... -
02 프로젠, 유럽당뇨병학회서 'PG-102' 전임상·... -
03 약사회, 대통령실 앞 릴레이 시위 돌입…“한... -
04 관세청, K-뷰티 수출 확대 위해 무역 장벽 ... -
05 혁신 비만치료제 개발 가속 '한미약품' 신약... -
06 미국 하원, 2026 국방수권법안 통과...‘생물... -
07 애경산업, 세계화장품학회서 연구성과 2건 발표 -
08 앱클론, 차세대 카티 치료제 '네스페셀' 개... -
09 GC녹십자,독감백신 ‘지씨플루’ 누적 생산량... -
10 마티카바이오랩스,사이알바이오와 CDMO 계약...











