뉴스
코로나19 백신 조기개발 지원 가이드라인 발간
임상시험 2건·비임상단계 9건 맞춤형 지원
박선혜 기자 │ loveloveslee@yakup.com


입력 2020-06-16 13:29
식품의약품안전처(처장 이의경)는 코로나19 백신의 임상시험 조기 진입을 돕고 제품화를 지원하기 위한 가이드라인을 발간했다.
주요 내용은 ▲임상시험용의약품의 품질자료 요건 ▲독성시험 등 비임상시험 고려사항 ▲최초 임상시험 시 고려사항 ▲안전성·유효성·면역원성 평가항목 설정 시 고려사항 ▲세계보건기구(WHO) 코로나19 백신 지침(부록) 등이다.
한편, 식약처는 ‘K-백신 신속심사 추진반*’을 통해 코로나19 백신 개발 11개 업체에 맞춤형 상담을 제공하고 있으며, 임상시험 단계로 신속히 진입할 수 있도록 지원하고 있습니다.
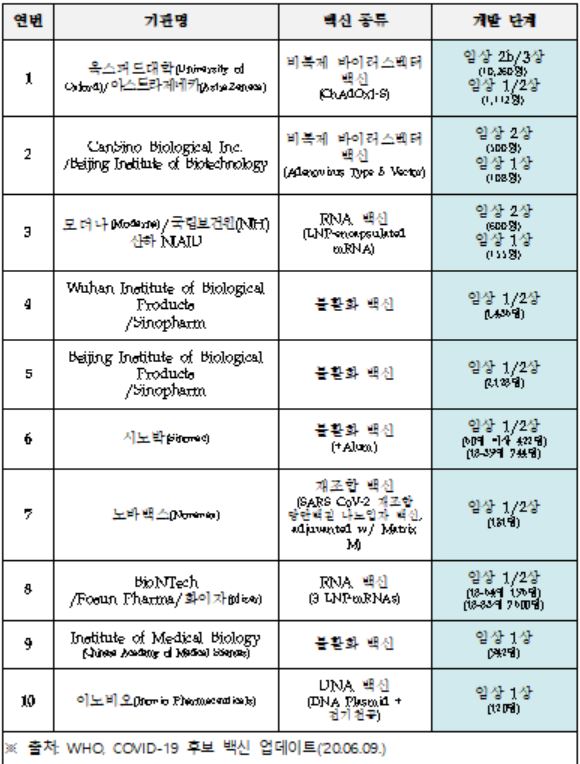
|
식약처는 앞으로도 국내에서 코로나19 백신이 조속한 시일 내에 개발될 수 있도록 새로운 과학적 정보, 국내·외 임상시험 정보를 제공하는 등 백신 개발업체를 적극 지원할 계획이다.
자세한 내용은 식약처 홈페이지(www.mfds.go.kr)→법령자료→법령정보→공무원지침서‧민원인안내서에서 확인할 수 있다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 아이넥스 'ENAD CADx',대장내시경 AI 분야 ... -
02 코스메카코리아, 2년 연속 에코바디스 실버 ... -
03 시지바이오,척추 임플란트 ‘노보맥스 퓨전’ ... -
04 GC녹십자, 단일세포 클로닝 기반 고도화된 ... -
05 신테카바이오-엔바이오스, 암질환 치료제 타... -
06 코스맥스 이경수 회장, 그룹 33년사 담은 ‘... -
07 서울대로 돌아온 리가켐 김용주 대표…"ADC, ... -
08 “비만이 전부가 아니다”…한미, 혁신 표적항... -
09 아이빔테크놀로지, 자이메디- 한국기초과학... -
10 알테오젠, ADC 피하주사 제형 개발 기술 PCT...











