
‘바이오소부장(소재, 부품, 장비)’의 국산화가 시급하다는 지적이 나왔다. 바이오산업이 급성장하면서 바이오소부장 수요가 급증하고 있으나, 외국 의존도가 90%에 달해 국내 바이오산업 발전에 걸림돌이 될 수 있기 때문이다.
|
바이오소부장은 바이오산업의 연구개발, 제조, 생산, 서비스 등의 과정에서 필요한 다양한 ‘소재’ ‘부품’ ‘장비’ 등을 가리킨다. 바이오의약품, 바이오시밀러, 생물학적 제제, 바이오 디바이스 등 다양한 분야에서 제품을 개발하고 생산하는 데 없어선 안되는 것들이다. 바이오협회에 따르면 현재 글로벌 기업 5개사(머크, 사이티바, 론자, 사토리우스, 써모피셔사이언티픽)가 글로벌 시장의 80% 가까이 점유하고 있다.
셀라토즈 테라퓨틱스 황정욱 연구원은 22일 국산 바이오소부장 활성화와 발전을 위해선 △바이오소부장 기술 개발 및 혁신 △원부자재 및 부품 국산화 △협력 체계 구축 △정부 지원이 필요하다고 강조했다. 황 연구원은 이같은 내용을 골자로 한 리포트 ‘바이오산업 소부장 국내현황 및 경쟁력과 발전 방향’을 BRIC(포항공대 생물학전문연구정보센터) 동향리포트로 게재했다.
황 연구원은 “국내 기업들이 우수한 품질을 가진 바이오소부장을 개발하는 것이 가장 중요하다”면서 “국내 기업들은 글로벌 기업의 바이오소부장과 동등 이상의 품질을 확보하기 위해 지속해서 연구개발에 투자하고 혁신 기술 개발에 주력해야 한다”고 전했다.
황 연구원은 “경쟁 제품 대비 우수한 품질을 가진 소부장 개발과 이를 지속, 생산할 수 있는 인프라가 갖춰져야 한다”고 말했다. 바이오의약품 특성상 아무리 작은 소부장의 불량으로도 최종 완제품 품질이 부적합하게 될 수 있다. 따라서 일정 수준의 품질이 보장돼야 국내 생명과학 기업들이 국산 제품을 선택할 수 있게 된다는 것이다.
또한 황 연구원은 바이오소부장의 발전을 위해선 정부 지원이 필수로 따라와야 한다고 강조했다. 황 연구원은 “앞서 있는 글로벌 바이오소부장 기술과 인프라를 따라잡기 위해 정부 차원의 예산 투입, 세제 혜택과 같은 금전적인 지원이 필요하다"면서 "또한 규제 개혁, 가이드라인 제정과 같은 제도적인 지원도 병행해야 한다”고 말했다.
이 외에도 황 연구원은 △정부, 산업체, 연구기관 간의 협력 체계 구축 △바이오소부장 특화단지 구축 △바이오소부장 인프라 구축 적극 지원 등으로 국산 바이오소부장이 제 자리를 잡아야 글로벌로 진출할 수 있다고 덧붙였다.
|
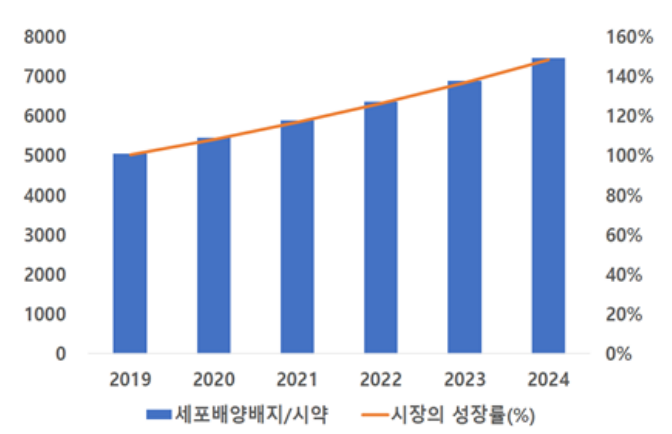
바이오소부장 중 가장 큰 시장을 형성하고 있는 분야는 ‘세포배양배지 및 시약’이다. 세포배양배지는 생명공학연구와 의약품 개발에 필요한 세포 배양의 주원료로 사용된다. 시약은 실험, 분석 및 첨가 물질로 사용되는 원료다.
산업통상자원부와 한국바이오협회가 운영하는 한국바이오산업정보서비스(KBIOIS) 데이터에 따르면 글로벌 세포배양배지 및 시약 시장은 2019년 기준 50억3200만 달러(약 6조7300억원)로 나타났다. 특히 이 시장은 2024년까지 74억 4700만 달러(9조9611억원) 규모로 확대될 전망이다.
바이오시밀러, 백신 등의 사용량이 증가하면서 ‘바이오필터’ 시장도 성장하고 있다. 바이오필터 시장은 2019년 기준 86억 달러(11조4999억원)로 추산됐고, 연평균 10%씩 성장해 2021년에는 100억 달러 규모(13조3740억원)에 이르렀다.
또한 ‘일회용백’ 시장은 2020년에 18억 6900만 달러(2조5000억원)로 평가됐고, 연평균 복합성장률(CAGR)이 16.9%로 분석, 2028년에는 65억2900만 달러(8조7330억원)까지 성장할 전망이다. 일회용백은 세포배양, 버퍼, 멸균배지, 혈청 및 시약 보관을 위한 용도로 다양한 용량의 일회용백 수요가 증가하고 있다.
황 연구원은 “코로나19로 인해 중요성이 대두된 바이오소부장 산업의 자립화에는 여전히 해결해야 할 과제가 많다”면서 “바이오소부장 국산화에 성공하기 위해선 기술적인 측면과 정책적인 측면을 고려하는 동시에 국내외 다양한 정책안을 기반으로 한 선제적 준비가 필수”라고 전했다.
한편 셀라토즈테라퓨틱스는 세포·유전자치료제 신약개발과 더불어 바이오소부장 중 배지 위탁 제조 사업을 진행 중이다. 셀라토즈테라퓨틱스는 1월 CMT1(Charcot-Marie-Tooth type 1, 샤르코-마리-투스병 1형) 환자를 대상으로 CLZ-2002의 안전성과 내약성을 평가하기 위한 임상 1상을 승인받았다.
-
01 약가 인하 "존립 위기" 규정…유통협회, 구조... -
02 보로노이,비소세포폐암 환자 'VRN110755' 임... -
03 지아이이노베이션,'GI-102' 단독-병용요법 ... -
04 지노믹트리, 고유 mRNA 전달용 지질 나노입... -
05 아이엠바이오로직스, ‘2025 국가연구개발 우... -
06 마이크로디지탈, 국가 그린바이오 인프라 핵... -
07 메지온 "희귀소아질환 '신속심사바우처'부활... -
08 케어젠,GLP-1 펩타이드 ‘코글루타이드’ FDA ... -
09 일동생활건강, ‘일동헬스케어’로 사명 변경 -
10 JW중외제약 ‘헴리브라’,소아 A형 혈우병 환...











