뉴스
상반기 '국내 백신 산업' 최신 동향…전년 생산실적 7,301억
19년 대비 54.7% 증가…7개 社에서 10개의 임상시험이 진행 중
권혁진 기자 │ hjkwon@yakup.com


입력 2021-08-19 06:00 수정 2021.08.19 06:17
백신은 감염병을 예방하는 가장 비용 효과적인 수단으로, 최근 코로나19 팬데믹으로 인해 `백신 주권`이라는 글로벌 안보 이슈로까지 대두되고 있다. 이에 따라 백신 개발 및 확보가 국가 경쟁력에 중요한 사항으로 평가받고 있어 앞으로 귀추가 주목된다.
한국바이오의약품협회가 식품의약품안전처, 백신안전기술지원센터와 함께 국내 백신 개발 및 국내·외 최근 백신 관련 정책과 시장 동향 등을 담은 `2021년도 상반기 백신산업최신동향집`을 18일 발간했다.
보고서에는 △국내 백신산업 동향 △글로벌 백신산업 동향 △코로나19 백신산업 동향 △국내외 세미나 및 국제기구 소식이 수록돼 있다.
보고서에는 △국내 백신산업 동향 △글로벌 백신산업 동향 △코로나19 백신산업 동향 △국내외 세미나 및 국제기구 소식이 수록돼 있다.

|
국내 감염병 관련 준장기 계획에는 2006년 제2차 생명공학육성 기본 계획을 시작으로 최근까지 7차례 수립됐다. 최근 코로나19로 인해 백신 산업의 활성화를 위해 범정부 차원의 다양한 정책적 계획이 수립되고 있다.
보고서에 따르면 올해 정부 각 부처에서 `연구개발사업 종합시행계획`과 `바이오헬스 연구개발 투자전략 II` 계획을 수립하고 본격적인 바이오헬스 분야 활성화 알렸다. 과학기술정보통신부는 기초연구, 원천연구, 사업화, 인력양성, 기반 조성 분야로 구분해 지원할 예정이며, 백신 관련주요 사업에는 원천연구-바이오 분야 내 `미래감염병기술개발`사업으로 316억 5,900만원 규모로 지원할 계획이다.
또한 보건복지부는 신약개발 역량 제고를 위한 R&D강화를 위해 △코로나19 치료제·백신 비임상지원 74억원 △코로나19 백신 임상지원 387억원 △감염병 예방·치료 기술개발사업 125억원 △바이오의료 기술개발사업(미래감염병 기술개발) 317억원 △신·변종 감염병 대응 플랫폼 핵심기술 개발 102억원 △면역백신개발 지원 28억원 △백신 자급화 기술개발 248억원과 기타 제약산업 육성 기반을 조성하기 위해 약 120억원을 지원할 예정이다.
식품의약품안전처는 과도한 규제로 인해 백신 개발에 차질이 생기지 않도록 규제 개선을 진행하고, 민원인의 이해를 돕기 위해 가이드라인 발간, 교육, 대면 상담 등을 진행해 백신 개발과 생산에 전폭적인 지원을 약속했다.
또한 식품의약품안전평가원은 코로나19 백신 임상시험계획서 정보집, 코로나19 백신의 임상시험계획서 표준안, 바이오의약품별 국가출하승인 가이드라인 발간을 통해 국민의 건강 보호 및 백신의 안전성 확보를 위해 여러 방면에서 조력할 계획을 밝혔다.
|
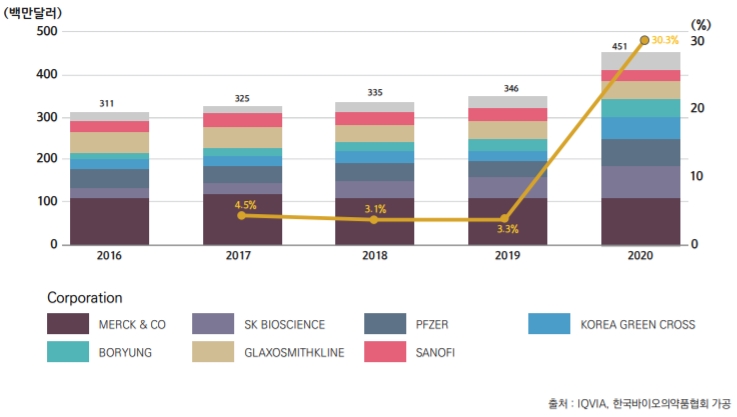
실제로 20년도 백신의 생산실적은 7,301억원으로 19년(4,812억원) 대비 54.7% 증가해 전체 바이오의약품 생산실적 중 유전자재조합의약품(19,961억원) 다음으로 2위를 차지했다. 또한 수출액은 15,179만달러로 19년 대비 35.5% 증가했으며, 수입액 역시 28.5% 증가한 29,655만달러를 기록했다.
이러한 백신산업의 성장은 19~20년도에 SK바이오사이언스의 `스카이셀플루4가`, GC녹십자의 `지씨플루쿼드리밸런트`, 보령바이오파마의 `플루VIII테트라`·`플루V테트라` 등 국내 백신기업의 4가 백신 제품의 매출이 평균 4배 이상 증가했기 때문으로 추정된다.
또한 20년도 백신의 생산, 수출, 수입 실적 또한 전년도 대비 높은 수준으로 증가했는데, 이는 코로나19 상황에서 독감 등 다른 질병 예방을 위한 백신 접종의 중요성이 강조되었기 때문으로 파악된다.
|
2021년도 상반기 국내 백신의 품목허가는 총 6건이며, 이 중 5건이 코로나19 예방백신으로 나타났다.
위 백신들은 영국, 이탈리아, 스웨덴, 미국에서 생산된 것이며 ‘한국아스트라제네카코비스-19백신주`만 SK바이오사이언스 안동공장에서 생산된다.
위 백신들은 영국, 이탈리아, 스웨덴, 미국에서 생산된 것이며 ‘한국아스트라제네카코비스-19백신주`만 SK바이오사이언스 안동공장에서 생산된다.
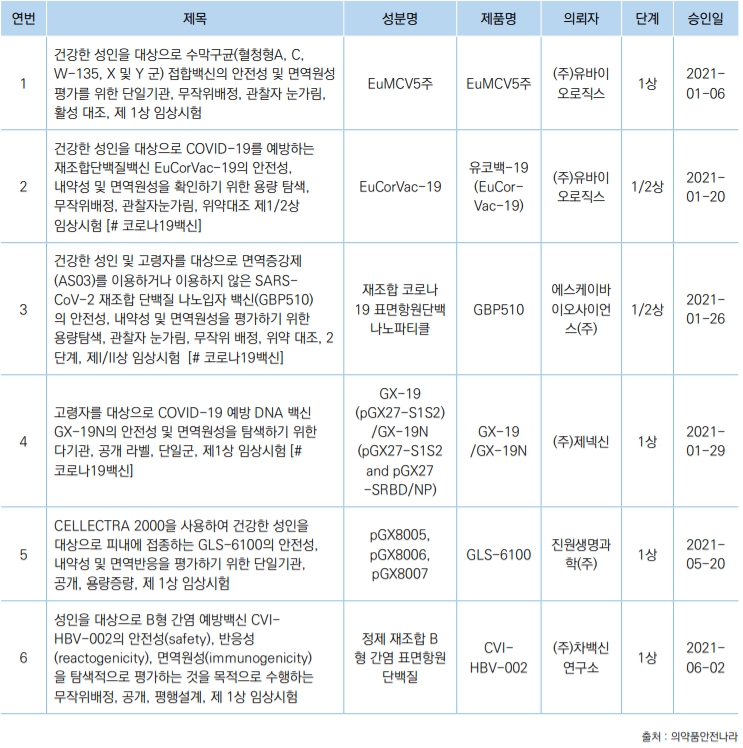
현재 국산 코로나19 백신은 허가된 사항이 없으며, 7개 기업에서 10개의 임상시험이 진행 중이고, 1개 기업에서 IND를 신청했다. 5개 기업에서 임상시험 진행 중인 백신은 4가지 플랫폼으로 △`Protein Subunit(재조합단백질)` 4개 △DNA 플랫폼 2개 △RNA 플랫폼 2개 △non-Replicating ViralVector(비증식 바이러스성 전달체) 1개다.
또한 SK바이오사이언스의 백신은 3상 임상시험에 진입했으며, 아이진은 지난 6월 30일 임상 1/2a상을 신청해 승인을 기다리고 있다.
또한 SK바이오사이언스의 백신은 3상 임상시험에 진입했으며, 아이진은 지난 6월 30일 임상 1/2a상을 신청해 승인을 기다리고 있다.

|
백신안전기술지원센터는 “국가 백신 제품화 기술지원사업의 일환으로 벤처 등 중소 백신 개발사의 제품 개발 초기 단계부터 허가까지 전 과정에 대하여 애로사항을 파악하고 전문가 컨설팅을 지원한다”고 밝혔다.
이어 “국내에 생산 공장이 있는 국내 기업체 및 기초 기술 보유 벤처 기업 등이 지원 대상”이며 "국내를 비롯해 해외 진출에도 전폭적으로 지원할 계획"이라고 덧붙였다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 "과학자 2700명 모였다" 한국분자·세포생물... -
02 현대바이오 "페니트리움, '가짜내성 제거 기... -
03 GC녹십자 창립 58주년, ”도전 정신으로 미래... -
04 싸토리우스, 10월 '바이오 DSP 심포지엄' 개... -
05 K-바이오랩허브사업추진단, 첨단재생의료산... -
06 SK바이오사이언스, 영유아 RSV 예방 항체주... -
07 셀트리온, UEGW 2025서 ‘램시마SC’ 장기 임... -
08 알리코제약, '알듀카정' 앞세워 650억 고... -
09 SK바이오팜, 역대 최대 실적 기틀 마련 미국... -
10 프로티움사이언스, 누적 수주액 400억원 달...











