
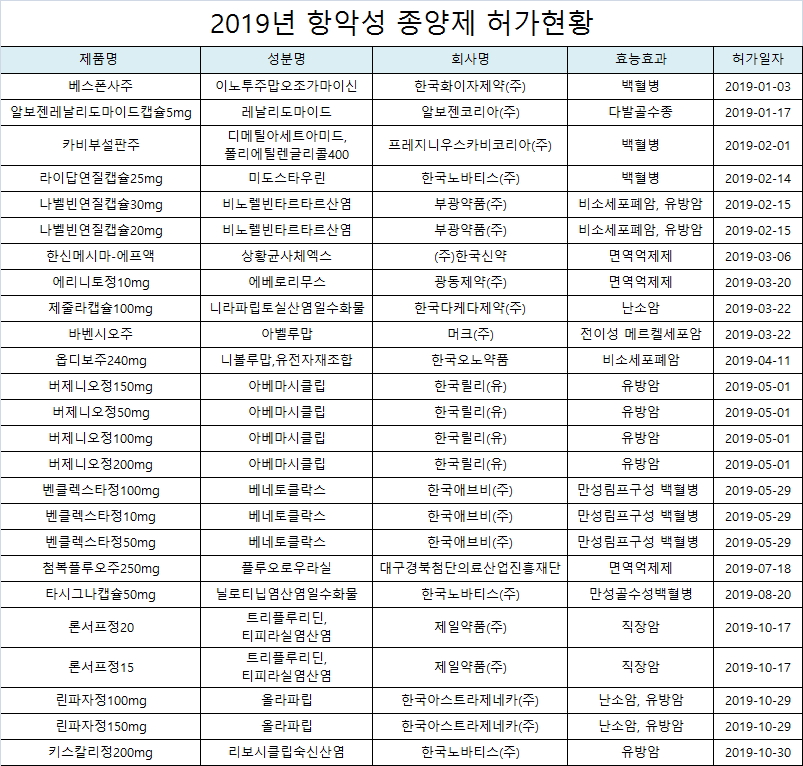
지난해 폐암치료제 유전자치료제인 '옵디보주240mg' 등 17개 성분 25품목의 항암제가 국내에서 허가받은 것으로 나타났다.
식품의약품안전처의 의약품 허가 현황에 따르면 지난해 1월 한국화이자제약의 백혈병치료제 '베스폰사주'를 시작으로 10월 30일 한국노바티스의 '키스칼리정200mg' 등 총 17개성분 25개 품목의 항악성 종양제가 허가를 받았다.
적응증으로는 백혈병치료제가 7품목으로 가장 많았고, 유방암치료제 6품목, 비소세포폐암치료제 3품목 등의 순이었다.
백혈병치료제는 베스폰사주, 카비부설판주, 라이답연질캡슐25mg, 벤클렉스타정100mg, 벤클렉스타정10mg, 벤클렉스타정50mg, 타시그나캡슐50mg등이 허가를 받았다.
유방암치료제는 나벨빈연질캡슐30mg, 나벨빈연질캡슐20mg, 버제니오정150mg, 버제니오정50mg, 버제니오정100mg, 버제니오정200mg 등 6품목이었다.
국내 제약업체는 △알보젠코리아의 다발성골수종치료제 '알보젠레날리도마이드캡슐5mg' △부광약품의 비소세포폐암·유방암 치료제 '나벨빈연질캡슐20mg' △한국신약의 생약면역억제제 '한신메시마-에프액' △광동제약의 면역억제제 '에리니토정10mg' △제일약품의 직장암치료제 '론서프정20' '론서프정15' △대구경북첨단의료산업진흥재단의 '첨복플루오주250mg' 등 6개 회사 7개 품목이 허가를 받았다.
다국적 제약사는 한국릴리를 비롯해 11개 업체 18품목의 항암제가 허가받았다.
한국다케다제약은 '제줄라캡슐100mg'을 2차 이상의 백금기반 항암화학요법에 완전·부분 반응한 백금민감성 재발성 고도장액성 난소암(난관암 또는 일차 복막암 포함) 성인 환자의 단독 유지요법으로 허가받았다.
|
머크는 국내 유일의 전이성 메르켈세포암 치료제인 '바벤시오주'를 허가받았고, 한국릴리는 유방암치료제 신약인 '버제니오정100mg' 등 4개 품목을 허가받았다.
한국에브비는 국내 최초이자 유일한 경구용 B세포 림프종-2(BCL-2, B-cell lymphoma-2) 억제제인 '벤클렉스타정(VENCLEXTA, 성분명: 베네토클락스(venetoclax)) 50mg' 등 3품목을 만성 림프구성 백혈병(CLL, Chronic Lymphocytic Leukemia) 치료제로 5월 29일 허가받았다.
한국아스트라제네카의 '린파자정100mg' 린파자정150mg'은 성인 난소암 및 유방암을 적응증으로 10월 29일 허가받았다.
노바티스의 키스칼리정200mg'는 호르몬 수용체(HR) 양성 및 사람 상피세포성장인자 수용체2(HER2) 음성인 진행성 또는 전이성 유방암환자 치료제 신약으로 10월 30일 허가받았다.
-
01 "과학자 2700명 모였다" 한국분자·세포생물... -
02 현대바이오 "페니트리움, '가짜내성 제거 기... -
03 GC녹십자 창립 58주년, ”도전 정신으로 미래... -
04 싸토리우스, 10월 '바이오 DSP 심포지엄' 개... -
05 K-바이오랩허브사업추진단, 첨단재생의료산... -
06 SK바이오사이언스, 영유아 RSV 예방 항체주... -
07 셀트리온, UEGW 2025서 ‘램시마SC’ 장기 임... -
08 알리코제약, '알듀카정' 앞세워 650억 고... -
09 SK바이오팜, 역대 최대 실적 기틀 마련 미국... -
10 프로티움사이언스, 누적 수주액 400억원 달...











