뉴스
항암제 '에토포시드' 성분제제, 이상반응에 '급성신부전증' 추가
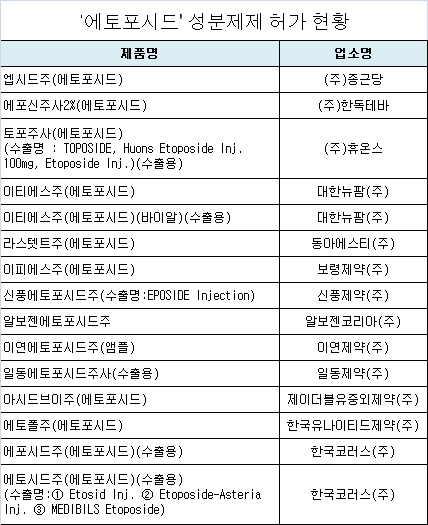
식약처, 미국 FDA 안전성 정보 검토…'엡시드주' 등 15품목 허가사항 변경
김용주 기자 │ yjkim@yakup.com


입력 2019-08-02 12:00 수정 2019.08.02 12:02
|
식품의약품안전처는 '에토포시드' 성분제제의 미국 식품의약품청(FDA) 안전성 정보와 관해 국내·외 허가 현황, 제출의견 등을 종합 검토한 결과에 따라 13개사 15품목에 대해 8월 19일자로 허가사항 변경지시를 내렸다고 밝혔다.
'에토포시드' 성분 제제의 대표 품목은 종근당의 '엡시드주'이다.
'엡시드주'는 소세포폐암, 악성림프종, 급성백혈병, 고환종양, 방광암, 융모성질환의 효능효과를 갖고 있다.
식약처는 '에토포시드' 성분제제의 허가사항중 이상반응항에 '급성신부전증 : 조혈모세포 이식을 위해 에토포시드 고용량(2220 mg/m2) 투여 및 전신조사(total body irradiation) 후 가역성 급성 신부전증 발병이 보고 되었다. 급성 신부전증은 덱스트란 40을 함유한 에토포시드 성분제제를 고용량으로 투여한 것과 관련되어 있다'는 내용을 신설하도록 했다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 대한약사회 “정부는 한약사 문제 즉시 해결... -
02 바이오솔루션,연골세포치료제 '카티로이드' ... -
03 동아쏘시오홀딩스, 바이오시밀러 상반기 매... -
04 유한클로락스,창립 50주년 새 기업 로고 공개 -
05 GC녹십자,텍사스주 혈장센터 개소..내년 상... -
06 HLB, HLB사이언스 흡수합병... 패혈증 신약 ... -
07 부광약품 자회사 콘테라파마, ‘CP-012’ 1b상... -
08 바이오솔루션, 흥케이병원과 연골재생치료 ‘... -
09 명인제약, 공모가 상단 58000원 확정…의무보... -
10 이엔셀, 세계 최대 세포유전자치료제 컨퍼런...











