신물질 34개-바이오신약 12개...면역관문억제제-항체약물접합체 2개씩 승인
FDA 격동 한 해...허가 감소, 신약개발 - 투자 심리 부정적 요인 작용할 수 있어

2025년 미국 FDA가 총 46개 신약을 허가했다. 승인 신약은 항암제가 가장 많았고, GSK와 노바티스를 포함한 6개 글로벌 제약사가 각 2개씩 승인받았다. 또 2025년 신약 승인 수에서 중국이 처음으로 미국을 앞질렀다.
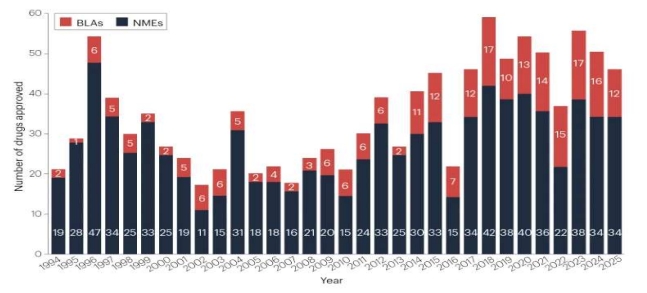
국제학술지 네이처 리뷰 드럭 디스커버리(Nature Reviews Drug Discovery)의 ‘2025 FDA approvals’(2026.1.2.)에 따르면 2025년 한해 미국 FDA 의약품평가연구센터(CDER)는 신물질신약(NME) 34개, 바이오신약(BLA) 12개 등 총 46개 신약을 허가했다. 2024년 50개에 비해 4개가 적고, 2023년 55개에 비해서는 9개가 적은 수치다.
여기에는 면역관문억제제(PD-1) 2개(머크 피하주사제형 ‘키트루다’-Keytruda Qlex), 중국 아케소 바이오파마 ‘펜풀리맙’-Penpulimab)와 항체약물접합체(ADC) 2개(일본 다이이찌산쿄 TROP2 표적 ADC ‘Datroway’, 미국 애브비 c-Met 표적 ADC ‘Emrelis’)가 포함됐다.
승인기업은 GSK, 노바티스, 머크, 베링거잉겔하임, 사노피, 바이엘 헬스케어가 각 2개씩 허가를 받았다.
적응증별로는 항암제가 16개(35%)로 가장 많은 허가 비중을 차지했다. 심장질환(Cardiovascular)이 5건(11%), 알레르기 및 염증성 질환이 4건(9%)으로 뒤를 이었다.
|
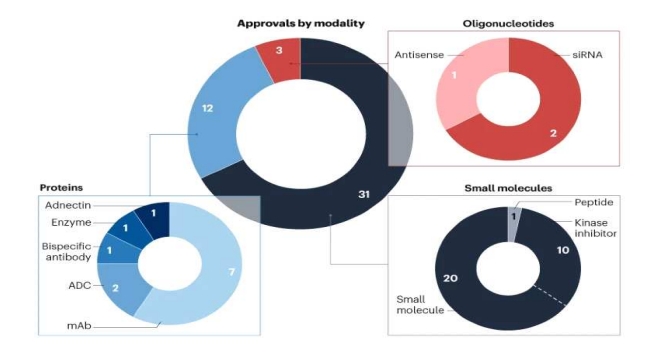
승인받은 46개 신약을 모달리티로 구분해보면, 저분자신약 31개, 바이오신약 12개, 올리고 뉴클레오타이드 3개였다. 저분자신약에는 저분자 20개, 키나아제 저해제 10개, 펩타이드성 저분자 신약 1개가 포함됐다.
특히 암세포 내부에서 비정상적으로 활성화된 키나아제 효소를 차단해 암세포 성장을 억제하는 키나아제 억제제가 새로 승인된 저분자신약 약 3분의 1을 차지하는 역대 최대 규모 해로 기록됐다.
바이오신약은 단일클론항체(mAb) 7개, 항체약물접합체(ADC) 2개, 이중특이항체(Bi-specific), 효소, 아드넥틴 각각 1개 등 총 12개가 승인받았다. 특히, 항체와 유사한 치료 효능을 가지면서도 크기가 작은 아드넥틴(Adnectin) 기반 바이오신약이 최초 허가됐다.
올리고뉴클레오타이드 기반 치료제는 siRNA 2개, Antisense oligonucleotides 1개 등 총 3개가 허가됐다.
|
한국바이오협회는 “미국 FDA는 2025년 예산 삭감과 인력 감축이라는 격동의 한해를 보냈다. 2025년 FDA 허가 감소는 이 영향일 수 있으며, 2026년 안정화될지 더 큰 감소로 이어질지 지켜볼 필요가 있다”며 “ FDA 허가 감소는 신약개발은 물론 투자 심리에도 부정적 요인으로 작용할 수 있다”고 진단했다.
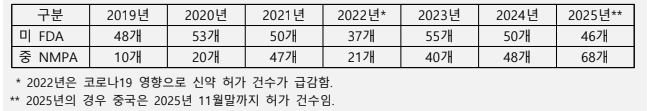
한편, 2025년 처음으로 신약 허가 건수에 있어 중국이 미국을 추월했다.
|
-
01 한림제약, 김정진 부회장 '회장' 승진...202... -
02 케어젠, ‘디글루스테롤’ 피부 개선·항노화 ... -
03 알지노믹스, 맞춤형 심장질환 치료제 개발 ... -
04 코스메카코리아, 공정거래 자율준수프로그램... -
05 강스템바이오텍, 2026 JP모건 헬스케어 콘퍼... -
06 리가켐바이오,MSD 출신 한진환 박사 신약연... -
07 티디에스팜,복합성분 비마약성 경피흡수제 ... -
08 제놀루션,김기옥·김민이 공동대표 출범…‘글... -
09 씨엔알리서치, 노바바이오 ‘잇몸 생체적합성... -
10 오름 테라퓨틱스,채드 메이 최고 과학 책임...











