뉴스
안과용제 ' 플루오로메톨론' 성분제제 허가사항 변경
식약처, '후메론점안액' 등 46개사 77품목
김용주 기자 │ yjkim@yakup.com


입력 2019-07-18 06:00 수정 2019.07.18 06:41
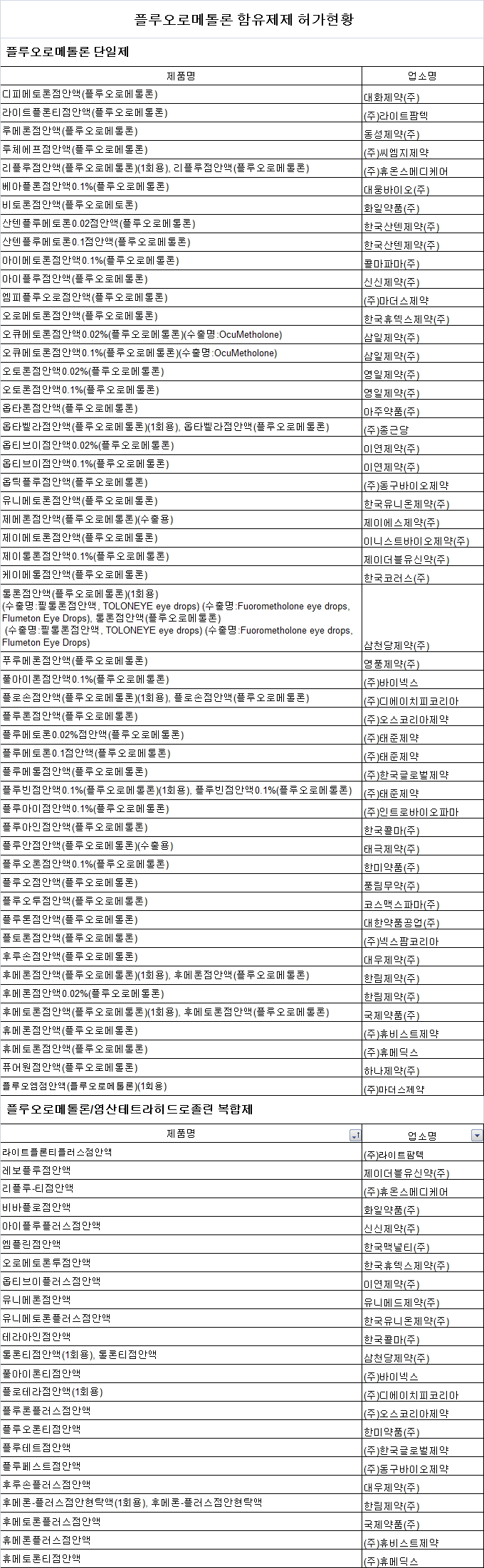
한림제약의 '후메론점안액' 등 안과용제 '플루오로메톨론' 성분 함유제제 77품목의 허가사항이 변경된다.
식품의약품안전처는 '플루오로메톨론' 함유제제의 안전성 정보와 관련해 국내외 허가현황 등을 토대로 허가받은 46개사 77품목의 허가사항을 8월 17일자로 변경지시했다고 밝혔다.
식약처는 허가사항중 일반적 주의 항에 '코르티코스테로이드의 전신적 이상반응은 어린이 및 CYP3A4 저해제(리토나비르 또는 코비시스타트 포함)치료를 받은 환자와 같이 취약한 환자가 안과용 코르티코스테로이드를 집중치료 또는 장기치료를 받은 후에 발생할 수 있다'는 내용을 추가하도록 했다.
또 상호작용항에 'CYP3A4 저해제 (리토나비르 또는 코비시스타트 포함)와 병용 투여시 전신 노출이 증가되어, 전신적 이상 반응 발생 위험이 증가할 수 있다. 치료상의 유익성이 전신 코르티코스테로이드 이상반응 발생의 위험성을 상회한다고 판단되는 경우에만 병용 투여하며, 환자의 전신 코르티코스테로이드 영향을 살펴야 한다'는 내용을 신설하도록 했다.
허가사항이 변경되는 품목은 플루오로메톨론 단일제 52품목, 플루오로메톨론/염산테트라히드로졸린 복합제 23품목, 플루오로메톨론/겐타마이신황산염 복합제 2품목 등이다.
|
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 현대바이오, 'CP-COV03' 뎅기열 베트남 임상... -
02 아이진, 유전자 재조합으로 제조 ‘보툴리눔 ... -
03 HLB펩, 13억원 규모 영업정지 처분 -
04 하엘,‘아시아 IPO 2025 컨퍼런스’ 1위 선정.... -
05 네이처셀 "미국에서 생명의 빛을 밝히겠습니... -
06 미국 VS 중국 바이오 긴장 고조 속 양국 합... -
07 엘앤씨바이오,동종신경 ECM '메가너브프라임... -
08 퓨쳐켐, 전립선암치료제 'FC705' 유럽종양학... -
09 제조업소 1/3, 작년 건기식 생산 전무 -
10 대한약사회, 한약사 불법조제 고발…“정부, 3...











