
|
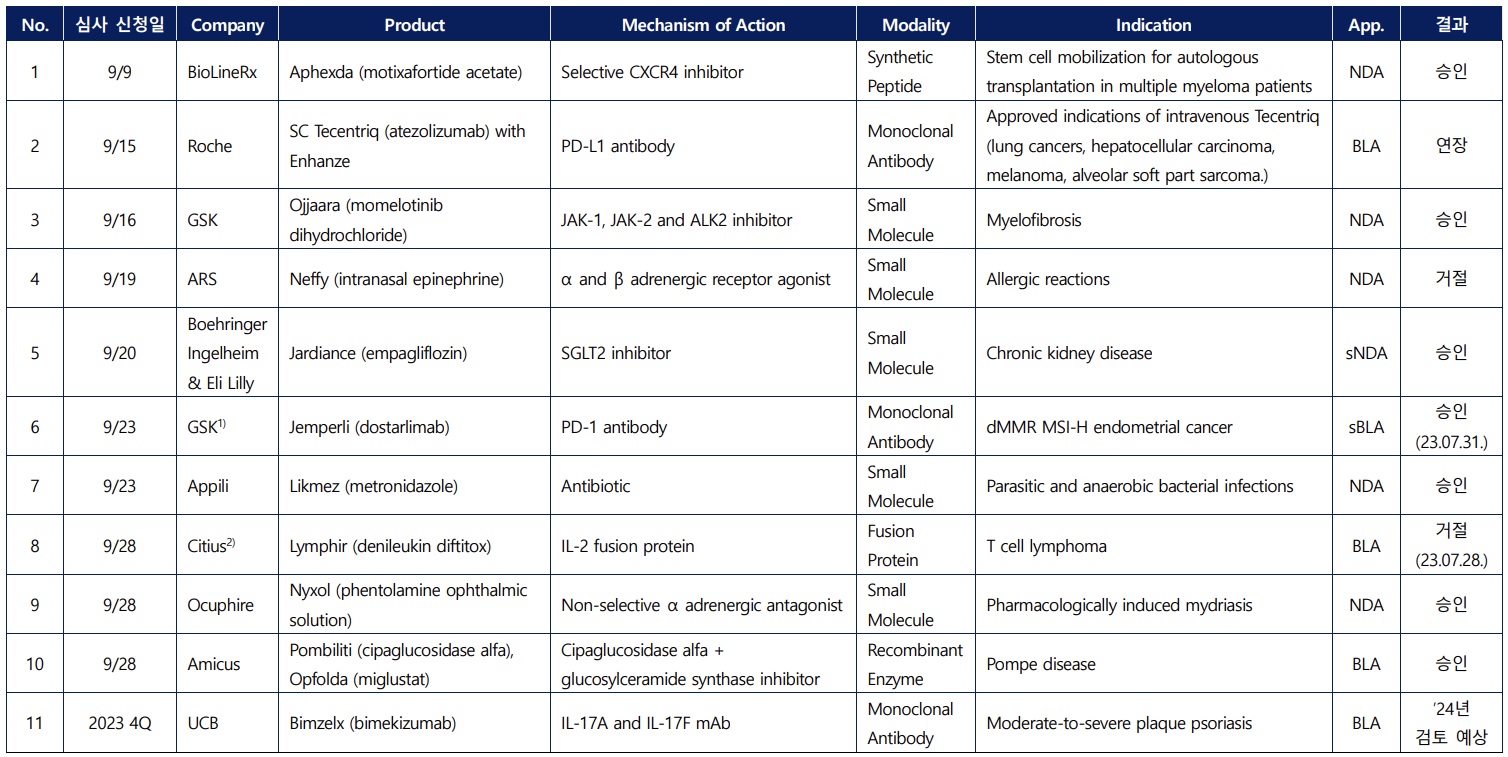
미국 식품의약국(FDA)이 지난달 전문의약품을 심사해 6개를 승인한 반면 4개는 거절하거나 심사를 연장한 것으로 확인됐다.
국가신약개발재단은 ‘2023년 9월 FDA 전문의약품 승인 심사 현황 및 결과’ 분석 자료를 최근 공개했다.
FDA는 지난달 전문의약품 승인 신청자 비용부담법(PDUFA)에 따른 허가 검토를 실시했다. 그 결과 아펙스다(Aphexda), 오자라(Ojjara), 폼빌리티(Pombiliti) 등 3건은 신규 승인됐다. 적응증 확대, 제형 변경, 개량신약 등의 사유로 기타 승인된 의약품도 3건 있었다.
반면 티쎈트릭(Tecentriq)SC는 제조공정 및 품질관리를 이유로 검토기한을 내년으로 연장했고, 네피(Neffy)는 에피네프린과의 반복투여 비교 연구를 요청받아 승인이 거절됐다. UCB의 건선치료제 후보물질인 빔젤스(Bimzelx)는 향후 FDA 신약 승인 검토를 앞두고 있다.
⃟아펙스다-필그라스팀 병용투여 효과 인정
이스라엘 소재 기업인 바이오라인Rx는 다발성 골수종에 대한 자가 조혈모세포 이식 치료를 위한 줄기세포 가동화제인 아펙스다(성분명: 모틱사포르티드)의 승인을 획득했다. 필그라스팀(Filgrastim, G-CSF)과 병용해 피하투여되는 아펙스다는 조혈모세포 자가이식 시 조혈모세포 증식 자극제로서의 역할을 하는 것으로 나타났다.
아펙스다와 필그라스팀 병용투여의 안전성과 효능을 필그라스팀 단독 투여와 비교한 GENESIS 임상3상 결과, CD34 세포 수집비율이 병용군의 경우 67.5%인 반면, 단독군에선 9.5%로 확인됐다. 줄기세포 수집 목표도달 비율 또한 병용군은 92.5%인 반면 위약군은 21.4%로 병용시 수집율이 높았다.
GSK의 오자라(성분명: 모멜로티닙)는 JAK1, JAK2, ALK2를 억제하는 골수섬유증 치료제다. GSK가 지난해 Sierra Oncology를 한화 약 2조5000억원인 19억 달러에 인수하면서 모멜로티닙을 획득했다. 오자라는 지난 6월 추가 결과를 평가받기 위해 허가심사 일정을 연장해 지난달 FDA 승인을 받았다.
FDA 승인 근거는 MOMENTUM 임상3상으로, 이전에 JAK 억제제로 치료 경험이 있는 골수 섬유증 환자를 대상으로 모멜로티닙과 합성 스테로이드 다나졸을 비교해 증상 및 비장 반응, 수혈 비의존성 등에서 다나졸 대비 통계적으로 유의성을 입증해 1,2차 평가 변수를 충족했다.
또한 SIMPLIFY-1 연구에서 JAK 억제제 치료를 받은 적이 없는 골수 섬유증 환자를 대상으로 모멜로티닙의 안전성 과 효능을 록소리티닙(Ruxolitinib, JAK1/JAK2 저해제)과 비교해 주요 평가항목인 비종 축소비율(35% 이상 축소)이 오자라 투여군 대비 열등하지 않고 수혈 비의존성도 개선된 것을 확인했다.
아미커스(Amicus)의 폼페병 치료제 폼빌리티(성분명: 시파글루코시다아제 알파)는 효소 안정제인 옵폴다(Opfolda, 성분명: 미글루스타트)와의 병용요법으로 승인을 획득했다. 이번 FDA 승인은 기존 효소 대체 요법제 치료 경험이 있는 성인 후기 발병형 폼페병(LOPD) 환자를 대상으로 한 PROPEL 임상3상 연구 결과를 바탕으로 한다.
연구 결과, 지구력 향상을 평가하는 6분 걷기거리(6MWD) 평가에서 폼빌리티 병용군은 52주차에 환자들의 6MWD가 위약+미글루스타트 투여군 대비 14m 개선된 것으로 나타났다. 폐기능을 평가하는 강제 폐활량(FVC) 평가에선 위약군 대비 평균 3%의 개선을 보여 통계적 유의성을 입증했다.
⃟자디앙, 만성 신장질환 치료제 적응증 추가
베링거 인겔하임과 일라이 릴리가 공동개발한 자디앙(Jardiance, 성분명: 엠파글리플로진)은 SGLT2 저해제로, 2014년 8월 제2형 당뇨병 치료제로 FDA 승인을 받았다. 자디앙은 당뇨병에 이어 △2021년 11월 ‘심박출률 감소 심부전(HFrEF) 치료제’ △지난해 5월 심박출률과 관계없이 ‘만성 심부전 환자(CHF) 치료제’로 승인을 얻었다.
올해 9월 승인으로 자디앙은 만성 신장질환(CKD) 치료제로 적응증을 추가했다. CKD 환자 6000여명을 대상으로 실시한 EMPA-KIDNEY 임상3상을 통해 자디앙은 신장질환의 진행 또는 심혈관계 사망 위험을 위약대비 28% 유의하게 감소시킨 것으로 나타나 1차 평가변수를 충족했다.
캐나다 애필리 테라퓨틱스(Appili Therapeutics)의 라이크메즈(Likmez)는 메트로니다졸(metronidazole)의 액상 경구 제형으로 올해 9월 승인을 받았다.
메트로니다졸은 미국에서 기생충 및 혐기성 세균 감염 치료에 매년 1000만건 이상 처방되는 최전선 경구 치료제로, 고형 정제 형태였다. 애필리는 고형 제형의 메트로니다졸 복용이 어려운 환자들에게 라이크메즈가 적절한 투여 제제로 대안을 제시할 것이라고 밝혔다.
⃟티쎈트릭, 내년으로 검토 연장
로슈는 티쎈트릭(성분명: 아테졸리주맙)이 그간에 승인받은 모든 적응증인 폐암, 간세포암종, 흑색종 및 폐포성 연부조직 육종에 대해 Enhanze 시스템(할로자임 테라퓨틱스의 약물전달 기술)을 도입한 피하 주사제(SC)에 대한 BLA의 승인을 신청했다. FDA 검토 결과를 받기 전, 로슈는 할리자임의 제조공정 및 품질관리에 대한 업데이트가 필요하다고 밝혀 티쎈트릭SC의 미국 출시 시기는 내년으로 미뤄졌다.
ARS 파마슈티컬스의 네피는 아나필락시스 환자의 응급치료에 쓰이는 에피네프린 비강 스프레이로, 기존의 주사제형을 대체할 새로운 제형으로 고안됐다. 지난 5월 자문위원회의 승인권고에도 불구, FDA는 에피네프린 주사제와 네피의 반복투여를 평가하는 약동학‧약력학 연구를 완료하도록 요청하면서 승인을 거절했다. ARS는 추가 연구 결과를 바탕으로 내년 상반기에 FDA 승인에 재도전할 계획이다.
이외에도 승인검토 대상 약물로는 UCB의 중증 판상 건선 치료제 ’비메키주맙‘이 있다.
-
01 “비만 치료제 다음은 RNA... 2026년, 데이... -
02 [2026 R&D①]정부 예산 35조5000억 ‘역대 최... -
03 코리아인스트루먼트,질병청 국립줄기세포재... -
04 건기식 소비자,‘스마트 컨슈머’로 진화…정보... -
05 경희대 연동건 교수팀, 만성 호흡기질환 변... -
06 JW중외제약, 탈모치료제 후보물질 ‘JW0061’ ... -
07 엘리시젠, 시리즈C 420억 규모 클로징…K-바... -
08 로킷헬스케어, 한국 바이오 최초 ‘AI 연골 ... -
09 에이비엘바이오-네옥바이오, 이중항체 ADC '... -
10 디앤디파마텍,MRE 기반 간 섬유화 평가기술 ...











