뉴스
'RWD 활용 의약품 안전관리 방안' 연구, 어떻게 추진될까
시판후 안전관리·적응증 추가·신약개발·데이터 품질 4개 분야
이승덕 기자 │ duck4775@yakup.com


입력 2019-07-11 16:48
국내 의약품 안전관리에 RWD(Real World Data, 실제임상자료)와 RWE(Real World Evidence, 실제임상증거)를 활용하는 방안의 연구가 추진된다.

|
성균관대 산학협력단이 주도하는 이번 연구에서는 보건의료와 제약산업 전문가 의견을 모으기 위해 2회에 걸친 회의를 수행했으며, 외부에서 수요조사를 통해 '시판 후 안전관리' 및 '적응증 추가' 등 부문에서 RWD 도입을 위해 풀어나가야할 과제/연구를 도출했다.
도출 결과, 연구사업 전략체계는 총 32개의 과제로 구성됐다.
연구는 국내 보건의료분야의 RWD와 IT 기술을 접목해 RWE로서 활용 가능한 근거기반 보건의료체계를 구축하는 것을 비전으로, RWD/RWE의 국내 보건의료 제도 도입 방안 및 국내 의약품 안전관리를 위한 활용계획 방안을 도출하는 것을 목표로 설정했다.
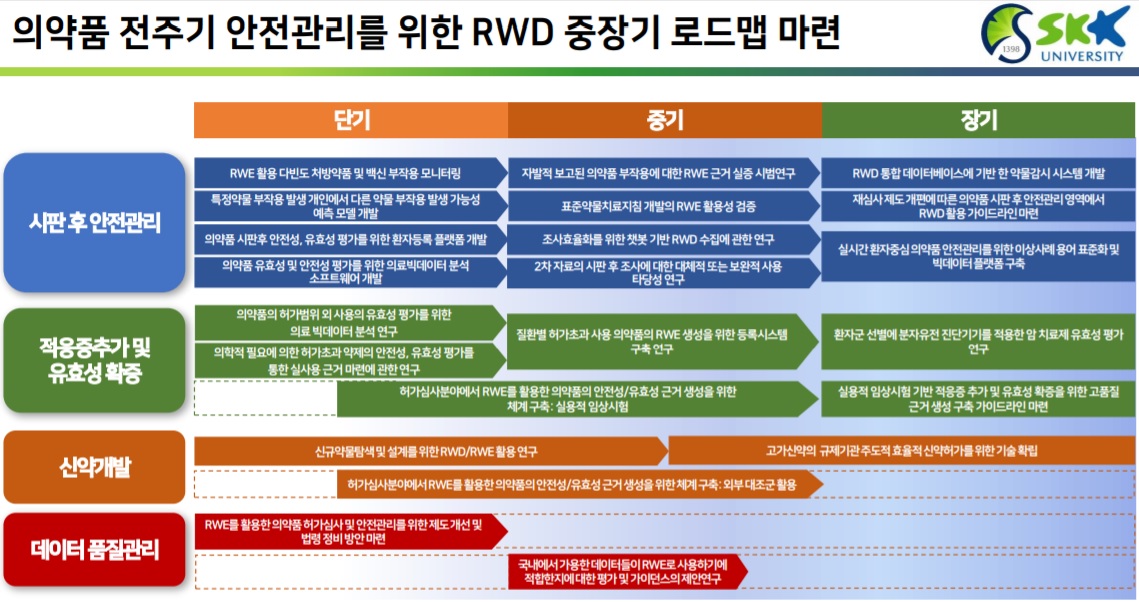
구체적으로는 △시판 후 안전관리 △적응증 추가 및 유효성 확증 △신약개발 △데이터 품질관리 4개 영역으로 세부과제가 추진된다.
'시판 후 안전관리' 영역에서는 표준약물치료지침개발의 RWE 활용성을 검증하고, 자발적으로 보고된 의약품 부작용에 대한 RWE 근거실증 시범연구와 특정 약물 부작용 발생 개인에서 다른 약물 부작용 발생 가능성 예측모델을 개발한다.
더불어 RWE 활용 다빈도 처방약품 및 백신 부작용 모니터링, 재심사 제도 개편에 따른 의약품 시판후 안전관리 영역에서 RWD 활용 가이드라인 마련, RWD 통합데이터베이스에 기반한 약물 감시시스템 개발, 실시간 환자중심 의약품 안전관리를 위한 이상사례 용어 표준화, 의약품 유효성·안전성 평가를 위한 의료빅데이터 분석 소프트웨어 개발 등도 함께 추진한다.
'적응증 추가 및 유효성 확증' 영역에서는 허가심사에서 RWE 활용 의약품 안전성·유효성 근거생성을 위한 실용적 임상시험 및 외부 대조군 활용 체계를 구축한다.
실용적 임상시험 기반 적응증 추가 및 유효성 확증을 위한 고품질 근거생성 가이드라인을 마련하고, 의약품 허가범위 외 사용(Off-label)의 유효성 평가를 위한 의료 빅데이터 분석연구 방안도 함께 마련된다.
|
'신약개발 영역'에서도 적응증 추가와 마찬가지로 RWE를 활용한 의약품 허가심사·안전관리를 위한 제도개선 및 법령 정비 방안을 마련하고, 실용적 임상시험 ·외부 대조군 활용 체계를 구축한다.
특히, 신규약물탐색 및 설계를 위한 RWD/RWE 활용, 고가신약의 식약처 주도 효율적 신약허가를 위한 기술확립 방안도 함께 모색한다.
'데이터 분야'에서는 국내에서 가용한 데이터들이 RWE로 사용하기에 적합한지에 대한 평가 및 가이던스의 제안을 연구한다.
이들 연구과제들은 단기-중기-장기적 과제를 통해 연차별로 추진될 예정이다.
전체댓글 0개
등록된 댓글이 없습니다.
오늘의 헤드라인
-
01 현대바이오, 'CP-COV03' 뎅기열 베트남 임상... -
02 아이진, 유전자 재조합으로 제조 ‘보툴리눔 ... -
03 HLB펩, 13억원 규모 영업정지 처분 -
04 하엘,‘아시아 IPO 2025 컨퍼런스’ 1위 선정.... -
05 네이처셀 "미국에서 생명의 빛을 밝히겠습니... -
06 미국 VS 중국 바이오 긴장 고조 속 양국 합... -
07 엘앤씨바이오,동종신경 ECM '메가너브프라임... -
08 퓨쳐켐, 전립선암치료제 'FC705' 유럽종양학... -
09 제조업소 1/3, 작년 건기식 생산 전무 -
10 대한약사회, 한약사 불법조제 고발…“정부, 3...











